
【题目】无水![]() 是一种重要的化工原料。某课外探究小组尝试制取无水
是一种重要的化工原料。某课外探究小组尝试制取无水![]() ,查阅资料获得下列信息:无水
,查阅资料获得下列信息:无水![]() 在
在![]() 升华,极易潮解,遇到水蒸气会产生白色烟雾。
升华,极易潮解,遇到水蒸气会产生白色烟雾。
探究一无水![]() 的实验室制备
的实验室制备
利用如图装置,用干燥、纯净的氯气在加热条件下与铝粉![]() 已除去氧化膜
已除去氧化膜![]() 反应制取无水AlCl3。供选择的药品:①铝粉②浓硫酸③稀盐酸④饱和食盐水⑤二氧化锰粉末⑥无水氯化钙⑦稀硫酸⑧浓盐酸⑨氢氧化钠溶液
反应制取无水AlCl3。供选择的药品:①铝粉②浓硫酸③稀盐酸④饱和食盐水⑤二氧化锰粉末⑥无水氯化钙⑦稀硫酸⑧浓盐酸⑨氢氧化钠溶液
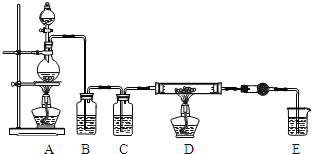
(1)写出装置A烧瓶中发生的反应方程式 ______ 。
(2)实验开始前,先检查装置气密性,然后装入药品,接下来的步骤依次是 ______ ![]() 填序号
填序号![]() 。
。
![]() 加热D中硬质玻璃管
加热D中硬质玻璃管
![]() 往A烧瓶中加入液体
往A烧瓶中加入液体
![]() 点燃A中的酒精灯
点燃A中的酒精灯
(3)上述供选药品中本实验无需用到的是 ______ ![]() 填数字序号
填数字序号![]() 。
。
(4)写出无水![]() 与水蒸气反应的化学方程式 ______ 。
与水蒸气反应的化学方程式 ______ 。
探究二无水![]() 的含量测定及结果分析
的含量测定及结果分析
取D中反应后所得固体![]() ,与足量氢氧化钠溶液反应,测定生成气体的体积
,与足量氢氧化钠溶液反应,测定生成气体的体积![]() 体积均换算成标准状况
体积均换算成标准状况![]() ,重复测定三次,数据如下:
,重复测定三次,数据如下:
第一次实验 | 第二次实验 | 第三次实验 | |
D中固体用量 |
|
|
|
氢气的体积 |
|
|
|
(5)根据表中数据,计算所得固体中无水![]() 的质量分数 ______ 。
的质量分数 ______ 。
(6)有同学认为测得的无水![]() 的质量分数偏低,你认为可能的原因有 ______ 。
的质量分数偏低,你认为可能的原因有 ______ 。
探究三离子浓度对氯气制备的影响
二氧化锰粉末和浓盐酸的反应随着盐酸的浓度降低,反应停止不再产生氯气。探究小组对盐酸浓度降低影响氯气生成的原因进行如下探究:
(7)提出假设假设1:![]() 浓度降低影响氯气的生成
浓度降低影响氯气的生成
假设2: ______ 。
(8)设计方案进行实验。限选试剂:浓![]() 、NaCl固体、
、NaCl固体、![]() 固体、稀盐酸。
固体、稀盐酸。
步骤 | 实验操作 | 预测现象和结论 |
| 往不再产生氯气的装置中,加入 ______ ,继续加热 | 若有黄绿色气体生成,则假设1成立 |
| ______ | 若有黄绿色气体生成,则假设2成立 |
【答案】![]()
![]() ③⑦
③⑦ ![]()
![]() 部分铝被氧气氧化生成氧化铝
部分铝被氧气氧化生成氧化铝 ![]() 浓度降低影响氯气的生成
浓度降低影响氯气的生成 ![]() 固体 往不再产生氯气的装置中,加入浓硫酸并继续加热
固体 往不再产生氯气的装置中,加入浓硫酸并继续加热
【解析】
本题分三部分,制备氯化铝、氯化铝的纯度分析、探究实验室制氯气的反应原理,其中氯化铝制备是利用二氧化锰和浓盐酸混合加热制得氯气与铝粉共热制备氯化铝,实验过程中要关注氯气的净化、保持无氧环境(防止生成氧化铝)、干燥环境(防氯化铝水解),并进行尾气处理减少对环境的污染;氯化铝样品中可能混有铝,利用铝与氢氧化钠溶液反应生成的氢气测定铝的含量,再计算出氯化铝的纯度;探究实验室制备氯气的原理可从来两个方面(1)氯离子浓度对实验的影响,(2)H+对实验的影响;
(1)实验室是利用二氧化锰与浓盐酸混合加热制氯气,可据此写出反应化学方程式;
(2)实验前装置里充满空气,空气中有氧气,必须先利用生成的氯气除去,否则制得的氯化铝中会混有氧化铝,根据此思路确定操作顺序;
(3)实验操作过程中制氯气需要浓盐酸和二氧化锰,除氯气中混合的氯化氢需要饱和食盐水,干燥氯气需要浓硫酸,铝粉与氯气反应制氯化铝,用氯化钙作干燥剂防水汽进入硬质管内,用氢氧化钠溶液吸收含有氯气的尾气,由此可分析不需要的化学药品;
(4)无水![]() 与水蒸气发生的是水解反应;
与水蒸气发生的是水解反应;
(5)根据三次实验生成的氢气求平均值,再根据生成的氢气求出参加反应的铝,即可计算出氯化铝的质量分数;
(6)氯化铝的含量偏低,除部分不参加反应的铝外,还可能有部分铝被氧气氧化;
(7)二氧化锰与浓盐酸反应的离子方程式为:![]() ,可见影响反应进行的应该是氯离子或氢离子的浓度;
,可见影响反应进行的应该是氯离子或氢离子的浓度;
(8)选择试剂时要注意,考虑氯离子时不要影响![]() 的浓度,同理考虑氢离子时不能影响氯离子浓度,故探究氯离子浓度的影响,只要通过氯化钠补充氯离子就可以了,探究
的浓度,同理考虑氢离子时不能影响氯离子浓度,故探究氯离子浓度的影响,只要通过氯化钠补充氯离子就可以了,探究![]() 浓度的影响只要探究添加浓硫酸补充
浓度的影响只要探究添加浓硫酸补充![]() 就可以了。
就可以了。
(1)实验室用二氧化锰与浓盐酸反应制氯气的反应方程式为:![]() ,
,
故答案为:![]() ;
;
(2)实验前装置里充满空气,空气中有氧气,必须先利用生成的氯气除去,否则制得的氯化铝中会混有氧化铝;故实验开始前,先检查装置气密性,然后装入药品,接下来先添加浓盐酸再加热A中酒精灯,待硬质玻璃管中充满黄绿色气体后再加热D装置,正确操作顺序为bca,
故答案为:bca;
(3)实验操作过程中制氯气需要浓盐酸和二氧化锰,除氯气中混合的氯化氢需要饱和食盐水,干燥氯气需要浓硫酸,铝粉与氯气反应制氯化铝,用氯化钙作干燥剂防水汽进入硬质管内,用氢氧化钠溶液吸收含有氯气的尾气,则不需要的药品是稀盐酸、稀硫酸即③⑦,
故答案为:③⑦;
(4)无水氯化铝遇水蒸汽会产生白色烟雾,AlCl3与水蒸气反应的方程式为![]() ,
,
故答案为:![]() ;
;
(5)三次实验收集到的氢气平均值为![]() ,氢气的物质的量为
,氢气的物质的量为![]() ,根据
,根据![]() ,可知铝的物质的量为
,可知铝的物质的量为![]() ,质量为
,质量为![]() ,氯化铝的质量分数为
,氯化铝的质量分数为![]() ,
,
故答案:![]() ;
;
(6)测得的无水AlCl3的质量分数偏低的原因可能是:部分铝粉被氧气氧化,混合有氧化铝,导致氯化铝含量偏低,
故答案为:部分铝被氧气氧化生成氧化铝;
(7)根据实验室利用浓盐酸和二氧化锰混合加热反应原理可知,参加离子反应的离子为氯离子和氢离子,另一种假设为![]() 浓度影响氯气的生成,
浓度影响氯气的生成,
故答案为:![]() 浓度影响氯气的生成;
浓度影响氯气的生成;
(8)可通过向反应装置中添加NaCl固体的方法增加溶液里的氯离子浓度,添加浓硫酸的方法增加溶液里的![]() 浓度,
浓度,
故答案为:NaCl固体;往不再产生氯气的装置中,加入浓硫酸并继续加热。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图1表示同温度下,pH = 1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线II为盐酸,且b点溶液的导电性比a点强
B. 图2表示0.1000 mol/L CH3COOH溶液滴定20.00mL0.1000mol/LNaOH溶液所得到的滴定曲线
C. 图3表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
D. 据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物E是合成农药茚虫威的中间体,其合成路线如下:

(1)写出A→B反应时还需的反应物及条件:__________。
(2)写出化合物D的结构简式:__________。
(3)写出一种符合下列条件的化合物E的同分异构体的结构简式:__________。
Ⅰ.既能发生银镜反应,也能与FeCl3溶液发生显色反应;
Ⅱ.含一个手性碳原子,核磁共振氢谱上有5种峰。
(4)根据已有知识并结合相关信息,写出以![]() 、HOOCCH2COOH、乙醇为原料制备
、HOOCCH2COOH、乙醇为原料制备![]() 的的合成路线流程图________________(无机试剂任用)。
的的合成路线流程图________________(无机试剂任用)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池放电、充电时的反应为:Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2 下列推断中正确的是( )
Fe(OH)2+2Ni(OH)2 下列推断中正确的是( )
放电时,Fe为正极,Ni2O3为负极
②充电时,阴极上的电极反应式是:Fe(OH)2+2e-===Fe+2OH-
③充电时,Ni(OH)2为阳极
④该蓄电池的电极必须是浸在某种碱性电解质溶液中
A.①②③ B.②③④ C.①②④ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A. 该溶液的pH=4 B. 升高温度,溶液的pH增大 C. 此酸的电离平衡常数约为1×10-7 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了达到下列的实验要求,请从供选择的化学试剂或实验方法中选出合适的,将其编号填入对应的空格中,并按要求写出相应的方程式。
供选择的化学试剂或实验方法如下:
A.加入NaOH溶液,过滤、洗涤、干燥
![]() 通入适量的
通入适量的![]()
C.通入![]() 气体
气体
![]() 加入适量铁粉
加入适量铁粉
E.加入![]() 溶液,观察
溶液,观察
![]() 加入澄清石灰水,观察
加入澄清石灰水,观察
G.丁达尔效应
(1)鉴别![]() 胶体和
胶体和![]() 溶液:______;
溶液:______;
(2)除去镁粉中的少量铝粉杂质______;
(3)除去![]() 溶液中
溶液中![]() :______,离子方程式______;
:______,离子方程式______;
(4)实验室保存![]() 溶液时要加入______
溶液时要加入______![]()
(5)除去![]() 溶液中的少量
溶液中的少量![]() 杂质:______。
杂质:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成甲、乙两组实验。![]() 、b为弹簧夹,加热及固定装置已略去
、b为弹簧夹,加热及固定装置已略去![]()
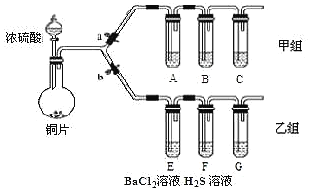
回答下列问题:
(1)制取![]() :写出铜与浓硫酸反应的化学方程式______。
:写出铜与浓硫酸反应的化学方程式______。
(2)用甲组装置验证酸性相对强弱:亚硫酸![]() 碳酸
碳酸![]() 硅酸
硅酸
①操作步骤:连接仪器、______、加药品后,打开a关闭b,然后滴入浓硫酸,加热;
②甲组试管中的试剂分别是:![]() 饱和溶液,B______,C______。试剂B的作用是______。
饱和溶液,B______,C______。试剂B的作用是______。
③能说明酸性:亚硫酸![]() 碳酸
碳酸![]() 硅酸的实验现象是______。
硅酸的实验现象是______。
(3)用乙组装置验证![]() 的某些性质。打开b,关闭a;
的某些性质。打开b,关闭a;
④![]() 溶液中有浅黄色浑浊出现,反应的化学方程式是______。
溶液中有浅黄色浑浊出现,反应的化学方程式是______。![]() 溶液中无明显现象,将其分成a、b两份,
溶液中无明显现象,将其分成a、b两份,
⑤试管a中滴加NaOH溶液,产生白色沉淀的化学式是_______。
⑥试管b中滴加![]() 溶液,也产生白色沉淀,产生白色沉淀的化学式是______。
溶液,也产生白色沉淀,产生白色沉淀的化学式是______。
⑦上述④⑤⑥的反应分别验证![]() 的性质依次是
的性质依次是![]() 填序号
填序号![]() ④______;⑤______;⑥______。
④______;⑤______;⑥______。
A.酸性氧化物的通性![]() 碱性氧化物的通性
碱性氧化物的通性![]() 还原性
还原性![]() 氧化性
氧化性![]() 漂白性。
漂白性。
(4)装置G中盛放的溶液是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修5:有机化学基础]
聚对苯二甲酸丁二醇酯(PBT)是一种性能优异的热塑性高分子材料。PBT的一种合成路线如图所示:

回答下列问题:
(1)A的结构简式是_________,C的化学名称是_________。
(2)⑤的反应试剂和反应条件分别是__________。
(3)F的分子式是_________,⑥的反应类型是_________。
(4)⑦的化学方程式是_________。
(5)M是H的同分异构体,同时符合_列条件的M可能的结构有_________种。
a.0.1 molM与足量金属钠反应生成氢气2.24 L(标准状况)
b.同一个碳原子上不能连接2个羟基
其中核磁共振氢谱显不3组峰,且峰而积之比为3:1:1的结构简式是_________。
(6)以2一甲基-1-3一丁二烯为原料(其它试剂任选),设计制备![]() 的合成路线:_________
的合成路线:_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com