
【题目】有某硫酸和硝酸的混合溶液20mL,其中含有硫酸的浓度为2mol/L,含硝酸的浓度为1mol/L,现向其中加入0.96g铜粉,充分反应后(假设只生成NO气体),最多可收集到标况下的气体的体积为
A.89.6mLB.112mLC.168mLD.224mL
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
【题目】为探究铝片(未打磨)与Na2CO3溶液的反应,实验如下:
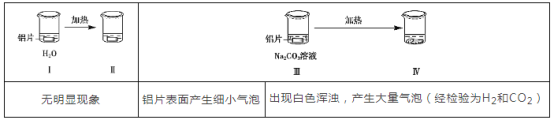
下列说法不正确的是( )
A. Na2CO3溶液中存在水解平衡:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
B. 对比Ⅰ、Ⅲ,推测Na2CO3溶液能破坏铝表面的氧化膜
C. Ⅳ溶液中可能存在大量Al3+
D. 推测出现白色浑浊的可能原因:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“循环经济”和“低碳经济”是目前备受关注的课题,因而对碳和硫的化合物的综合利用成为研究的热点。请回答下列问题:
(1)下列事实中,不能用来比较碳元素和硫元素非金属性强弱的是______(填选项字母)。
A.![]() 有漂白性而
有漂白性而![]() 没有
没有
B.少量![]() 能与
能与![]() 反应生成
反应生成![]()
C.![]() 能使酸性
能使酸性![]() 溶液褪色而
溶液褪色而![]() 不能
不能
D.![]() 溶液显碱性而
溶液显碱性而![]() 溶液显中性
溶液显中性
(2)下图是通过热循环进行能源的综合利用和污染治理的反应系统原理。

系统(Ⅱ)制氢气的热化学方程式为_________;两个系统制得等量的H2所需能量较少的是________。
(3)向10 L恒容密闭容器中充入2 mol CO和1 mol ![]() ,发生反应2CO(g)+SO2 (g)
,发生反应2CO(g)+SO2 (g)![]() S(g)+2CO2 (g)。CO和CO2的平衡体积分数(φ)与温度(T)的关系如图所示。
S(g)+2CO2 (g)。CO和CO2的平衡体积分数(φ)与温度(T)的关系如图所示。
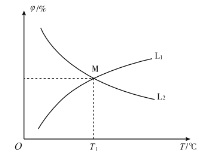
①图中能表示CO的平衡体积分数与温度关系的曲线为______(填“L1”或“L2”)。
②T1 ℃时,![]() 的平衡转化率α1=_______,反应的平衡常数
的平衡转化率α1=_______,反应的平衡常数![]() _________。
_________。
③只改变下列条件,既能加快该反应速率,又能增大CO的平衡转化率的是_____(填选项字母)。
A.增大压强 B.充入一定量![]()
C. 充入一定量![]() D.加入适当催化剂
D.加入适当催化剂
④向起始温度为![]() ℃的10 L绝热容器中充入2 mol CO和1 mol
℃的10 L绝热容器中充入2 mol CO和1 mol ![]() ,重复实验,该反应的平衡常数
,重复实验,该反应的平衡常数![]() _____
_____![]() (填“>”“<”或“=”),理由为_____。
(填“>”“<”或“=”),理由为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若![]() 与
与![]() 的电子层结构相同,且2个
的电子层结构相同,且2个![]() 原子与3个
原子与3个![]() 原子的电子总数相等,则下列说法正确的是
原子的电子总数相等,则下列说法正确的是
A. ![]() 为硫元素
为硫元素
B. ![]() 元素原子的外围电子排布式为
元素原子的外围电子排布式为![]()
C. ![]() 元素原子的核外电子排布式为
元素原子的核外电子排布式为![]()
D. ![]() 、
、![]() 都是元素周期表中
都是元素周期表中![]() 区的元素
区的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物K是某药物的前体,合成路线如图所示:
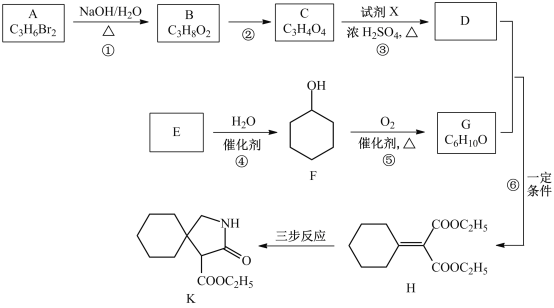
已知:R-CN![]()
![]() ;
;
![]()
![]() +
+![]()
(1)A的名称是_____________。
(2)反应①的化学方程式是___________________。
(3)反应②的类型是__________________。
(4)反应③中的试剂X是________________。
(5)E属于烃,其结构简式是_________________。
(6)H中所含的官能团是_________________。
(7)反应⑥的化学方程式是_____________________。
(8)H经三步反应合成K,写出中间产物I和J的结构简式______________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标号为①~⑩的元素,在元素周期表中的位置如下:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
试回答下列问题:
(1)写出元素③的名称__。
(2)①和④号元素形成的化合物的化学式为__,用电子式表示其形成过程为__。
(3)⑦和⑧号元素的最高价氧化物的水化物的碱性是:__﹥__
(4)①、⑤、⑦号元素形成的一种化合物的电子式是__,在该化合物中既含有__键,又含有__键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国政府承诺到2020年单位GDP二氧化碳排放比2005年下降40%~45%。CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:![]() ,测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
,测得CO2和CH3OH(g)的浓度随时间的变化如图所示。

(1)3~9min内,v(H2)=_________mol·L-1·min-1。
(2)能说明上述反应达到平衡状态的是________(填序号)。
A.反应中CO2与CH3OH的物质的量浓度之比为l:1(即图中交点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol CO2
D. CO2的体积分数在混合气体中保持不变
(3)平衡时CO2的转化率为________
(4)平衡时混合气体中CH3OH(g)的体积分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体X通入溶液A(如下图,尾气吸收装置略)中,实验现象能够支持结论的是
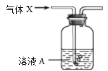
选项 | 气体X | 溶液A及反应现象 | 结论 |
A. | 乙醇与浓硫酸共热170℃产生的气体 | Br2的水溶液由橙黄色变为无色 | 乙烯与溴发生反应 |
B. | 电石与饱和食盐水反应产生的气体 | KMnO4酸性溶液紫色逐渐变浅 | 乙炔被高锰酸钾酸性溶液氧化 |
C. | 溴乙烷与氢氧化钠醇溶液共热生成的气体 | Br2的水溶液由橙黄色变为无色 | 乙烯与溴发生反应 |
D. | 碳酸钠固体与醋酸溶液反应产生的气体 | 苯酚钠溶液中出现白色沉淀 | 碳酸的酸性强于苯酚 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组进行下列实验:
①将0.1 mol·L-1 MgCl2溶液和0.5 mol·L-1 NaOH溶液等体积混合得到浊液
②取少量①中浊液,滴加0.1 mol·L-1 FeCl3溶液,出现红褐色沉淀
③将①中浊液过滤,取少量白色沉淀,滴加0.1 mol·L-1 FeCl3溶液,白色沉淀变为红褐色沉淀
④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解
下列说法中不正确的是( )
A. 将①中所得浊液过滤,所得滤液中含少量Mg2+
B. ①中浊液中存在沉淀溶解平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq)
Mg2+(aq)+2OH-(aq)
C. 实验②和③均能说明Fe(OH)3比Mg(OH)2难溶
D. NH4Cl溶液中的NH4+可能是④中沉淀溶解的原因
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com