
【题目】将4molA气体和2molB气体在2L的密闭容器内混合,并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种方法:
2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种方法:
①用物质A表示的反应的平均速率为0.3mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7mol·L-1
其中正确的是
A. ①③ B. ①④ C. ②③ D. ③④
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】下图是用自来水制备蒸馏水的实验装置图。
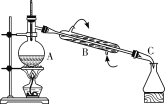
实验室蒸馏装置
(1)填写仪器名称:A:______________; B:________________; C:________________。
(2)图中有一处错误,请指出:________________________。
(3)蒸馏时,瓶中要先加几块沸石,其目的是________________。
(4)蒸馏时,取________℃的产品即可获得蒸馏水。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
下列说法正确的是
A.a = 1.64
B.此时刻正反应速率大于逆反应速率
C.若起始时加入2a mol CH3OH,则达到平衡时CH3OH的转化率增大
D.若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.124gP4含有的P-P键数为4NA(设NA表示阿伏伽德罗常数的值)
B.Be和NaOH溶液反应的离子方程式是:2Be+2OH-+2H2O=2BeO2-+3H2↑
C.在NaCl溶液中加入AgNO3溶液,生成白色沉淀;在加入氨水,沉淀消失。沉淀消失发生的离子方程式是:AgCl+2NH3·H2O=[Ag(NH3)2]++Cl-+2H2O
D.0.1mol/L的Fe3+溶液中,能大量共存的离子有Cl-、SO42-SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积等物质的量浓度的NaHCO3溶液和Ba(OH)2溶液混合,离子方程式正确的是
A. CO32— + Ba2+ → BaCO3↓
B. HCO3— + OH— → H2O + CO32—
C. HCO3— + Ba2+ + OH— → H2O + BaCO3↓
D. 2HCO3— + Ba2+ + 2OH— → BaCO3↓+ 2H2O + CO32—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中发生可逆反应:mA(g)+nB(g)![]() pC(g)+qD(g),当m、n、p、q为任意整数(不为零)时,不能说明达到平衡状态的标志是
pC(g)+qD(g),当m、n、p、q为任意整数(不为零)时,不能说明达到平衡状态的标志是
A. A的百分含量不再改变
B. 各组分的浓度不再改变
C. 反应速率υ(A):υ(B):υ(C):υ(D)=m:n:p:q
D. 单位时间内m mol A断键发生反应,同时p mol C也断键发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbO2、KMnO4、Cl2、FeCl3、CuCl2的氧化性依次减弱。下列反应在水溶液中不可能发生的是
A.Cu+2Fe3+=Cu2++2Fe2+
B.10Cl-+2MnO![]() +16H+=2Mn2++5Cl2↑+8H2O
+16H+=2Mn2++5Cl2↑+8H2O
C.2Fe2++Cl2=2Fe3++2Cl-
D.5Pb2++2MnO![]() +2H2O=5PbO2+2Mn2++4H+
+2H2O=5PbO2+2Mn2++4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。

下列叙述正确的是
A.通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2 H2O–4e–=O2+4H+,负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com