
 铜和镍是第四周期重要的过渡元素,它们的单质及化合物具有广泛用途,请回答以下问题:
铜和镍是第四周期重要的过渡元素,它们的单质及化合物具有广泛用途,请回答以下问题: ④HCHO,其中碳原子采取sp2杂化的分子有
④HCHO,其中碳原子采取sp2杂化的分子有| 1 |
| 8 |
| 1 |
| 2 |
| ||
| a3 |
| 3 |
| ||
| 3 |
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol Na加热时与O2反应失去的电子数目为NA |
| B、92g N2O4和92g NO2含有的原子数均为6NA |
| C、1L 0.1mol?L-1的盐酸中,所含HCl分子数为0.1NA |
| D、标准状况下,22.4L O3中含3NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCO3-+H2O?H2CO3+OH- |
| B、HCO3-+H2O?CO32-+H3O+ |
| C、HCO3-+OH-?CO32-+H2O |
| D、CO32-+H+=HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 正极 | Fe | Cu | Cu | C |
| 负极 | Cu | C | Fe | Cu |
| 电解质溶液 | Fe2(SO4)3 | Fe2(SO4)3 | CuSO4 | Fe2(SO4)3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
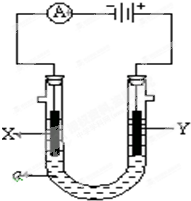 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、炔烃可以使溴的四氯化碳溶液褪色,不能使酸性高锰酸钾溶液褪色 |
| B、某有机物燃烧只生成等物质的量的CO2和H2O,则此有机物的组成为CnH2n |
| C、鉴定溴乙烷中溴原子的存在的实验操作是:向溴乙烷中加入NaOH溶液,加热后加入AgNO3溶液 |
D、在分子 中,处于同一平面上的碳原子最多可能有12个 中,处于同一平面上的碳原子最多可能有12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )| A、铅笔端有少量的氯气产生 |
| B、a点是正极,b点是负极 |
| C、铂片端作阳极,发生氧化反应 |
| D、铅笔端作阳极,发生还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com