
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 1 |
| 32 |


科目:高中化学 来源: 题型:
| A、所含原子数相等 |
| B、气体密度相等 |
| C、气体质量相等 |
| D、摩尔质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸溶液的导电性比盐酸弱 |
| B、向醋酸钠溶液中通入少量氯化氢,c(CH3COO-)减小 |
| C、0.1 mol/L的醋酸溶液的pH约为3 |
| D、pH=1的醋酸溶液用水稀释1000倍后,pH<4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钢铁的腐蚀过程绝大多数都是电化学腐蚀 |
| B、在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
| C、电解CuCl2饱和溶液,生成金属铜和氯气 |
| D、电解MgCl2饱和溶液,可制得金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
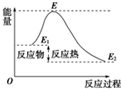
| A、反应物分子(或离子)间的每次碰撞是反应的先决条件 |
| B、反应物的分子的每次碰撞都能发生化学反应 |
| C、活化分子具有比普通分子更高的能量,催化剂能够减低活化能的数值 |
| D、活化能是活化分子的平均能量与所有分子平均能量之差,如图所示正反应的活化能为E-E1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 铜和镍是第四周期重要的过渡元素,它们的单质及化合物具有广泛用途,请回答以下问题:
铜和镍是第四周期重要的过渡元素,它们的单质及化合物具有广泛用途,请回答以下问题: ④HCHO,其中碳原子采取sp2杂化的分子有
④HCHO,其中碳原子采取sp2杂化的分子有查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com