
| A. | 升高温度,该反应的平衡常数将增大 | |
| B. | 从平衡混合气中分离出水蒸气可提高CO2和H2的利用率 | |
| C. | 再向该容器中充入2 mol H2和1 mol CO2,达到平衡时,H2的转化率将小于CO2 | |
| D. | T℃,在起始体积为V L的密闭容器(容积可变,恒压)中将3 mol H2和1 mol CO2混合,达到平衡时乙醇体积分数大于a |
分析 A.该反应是放热反应,升温平衡向吸热方向移动,平衡常数减小;
B.减小生成物浓度,平衡正向移动;
C.如加入3olH2和1molCO2,二者的转化率相等,此时加入2molH2和1molCO2,加入CO2的量相对较多,则达到平衡时,H2的转化率将高于CO2;
D.在体积可变的容器中进行,压强不变,相当于在原来的基础上增大压强,有利于平衡向正反应方向移动.
解答 解:A.该反应是放热反应,升温平衡向吸热方向即逆方向移动,平衡常数减小,故A错误;
B.从平衡混合气中分离出水蒸气即减小生成物浓度,平衡正向移动,提高CO2和H2的利用率,故B正确;
C.如加入3olH2和1molCO2,二者的转化率相等,此时加入2molH2和1molCO2,n(H2):n(CO2)<3:1,加入CO2的量相对较多,则达到平衡时,H2的转化率将高于CO2,故C错误;
D.如在恒容条件下进行,随着反应进行,容器的压强逐渐减小,但在体积可变的容器中进行,压强不变,相当于在原来的基础上增大压强,有利于平衡向正反应方向移动,则达到平衡时乙醇的体积分数大于a,故D正确.
故选:BD.
点评 本题考查温度、浓度、压强对化学平衡的影响以及温度与平衡常数的关系,掌握分析提高转化率的方法,这是高考高频考点,D选项灵活运用压强对平衡的影响解答,难度适中.


科目:高中化学 来源: 题型:解答题
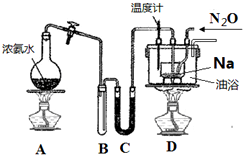 叠氮化钠 (NaN3) 常作为汽车安全气囊的药剂,其固体易溶于水,微溶于乙醇,不溶于乙醚.
叠氮化钠 (NaN3) 常作为汽车安全气囊的药剂,其固体易溶于水,微溶于乙醇,不溶于乙醚.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
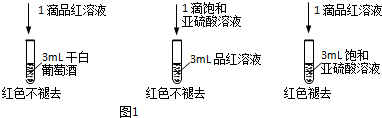
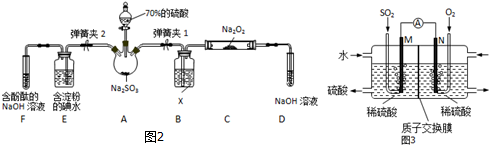
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 :下列对这种元素的分析中正确的( )
:下列对这种元素的分析中正确的( )| A. | 最外层电子数为3 | |
| B. | 最高价氧化物对应水化物的分子式可能是H3RO4 | |
| C. | 最高价为+3价 | |
| D. | 此元素可能是24号元素铬(Cr)或25号元素锰(Mn) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质谱法是快速、微量、精确测定相对分子质量的方法 | |
| B. | 红外光谱仪不可用于测定化合物的官能团 | |
| C. | 用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 | |
| D. | 氯溴碘代甲烷存在同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入Na2S2O3溶液,无明显现象 | |
| B. | 该溶液中Na+、K+、SiO32-、SO42-可以大量共存 | |
| C. | 加入FeCO3粉末,发生反应的离子方程式为:2FeCO3+2H+=2Fe2++CO2↑+H2O | |
| D. | 加入过量Cu粉和足量稀硫酸,可使溶液中几乎不含N元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
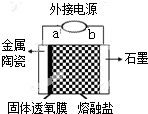 我国科学家最新研发的固体透氧膜提取金属钛工艺,其电解装置如图所示:将TiO2熔于NaCl-NaF融盐体系,以石墨为阴极,覆盖氧渗透膜的多孔金属陶瓷涂层为阳极,固体透氧膜把阳极和熔融电解质隔开,只有O2-可以通过.下列说法不正确的是( )
我国科学家最新研发的固体透氧膜提取金属钛工艺,其电解装置如图所示:将TiO2熔于NaCl-NaF融盐体系,以石墨为阴极,覆盖氧渗透膜的多孔金属陶瓷涂层为阳极,固体透氧膜把阳极和熔融电解质隔开,只有O2-可以通过.下列说法不正确的是( )| A. | a 极是电源的正极,Ti4+在熔融盐中从左往右迁移 | |
| B. | 阳极电极反应式为2Cl--2e-=Cl2↑ | |
| C. | 已知每摩尔电子的电量为965 00 C,理论上生成48mg钛,则电解过程中通过电解池的电量为386 C | |
| D. | NaCl-NaF融盐的作用是降低熔化TiO2需要的温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com