�ҹ��������Ϸ��ֺ�ʹ��ͭ��ͭ������Ĺ���֮һ��ֱ������ͭ���仯�����ڹ�ũҵ��������Ȼ���Ź㷺��Ӧ�ã�
��1����ҵ�Ͽ����û�ͭ����Ҫ�ɷ�CuFeS
2��Ϊԭ��ұ��ͭ����Ҫ��Ӧ���£�
��2CuFeS
2+4O
2=Cu
2S+3SO
2+2FeO ��2Cu
2S+3O
2=2SO
2+2Cu
2O
��Cu
2S+2Cu
2O=6Cu+SO
2�ڢ��б������뱻��ԭԪ��ԭ�ӵ����ʵ���֮��Ϊ
������3mol CuFeS
2����3molCu������������O
2 �����ʵ���Ϊ
��
��2��������Cu
2O������ϡ���ᣬ�õ���ɫ��Һ�ͺ�ɫ���壬�������ø����ʼ��鹤ҵ��ұ��ͭ�õ��Ĵ�ͭ���Ƿ���Cu
2O��д���˷�Ӧ�����ӷ���ʽ
��
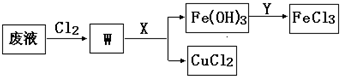
��3����ʴӡˢ��·�ķ�Һ�к��д�����CuCl
2��FeCl
2��FeCl
3�������ŷŽ����»�����Ⱦ����Դ���˷ѣ�Ϊ��ʹFeCl
3ѭ�����úͻ���CuCl
2���������ͼ�������̣�
���Լ�Y������
������X�����
���ѧʽ����
����������1L��Һ�к�CuCl
2��FeCl
2��FeCl
3�����ʵ���Ũ�Ⱦ�Ϊ0.5mol?L
-1�������Cl
2��������Xʹ��Һ��pH��
��Χʱ������Һ������ֲ��䣩����Ԫ����ȫת��ΪFe��OH��
3����CuCl
2 ������������
�� K
SP[Fe��OH��
3]=1.0��10
-38��K
SP[Cu��OH��
2]=2.0��10
-20��lg5=0.7��

 �ҹ��������Ϸ��ֺ�ʹ��ͭ��ͭ������Ĺ���֮һ��ֱ������ͭ���仯�����ڹ�ũҵ��������Ȼ���Ź㷺��Ӧ�ã�
�ҹ��������Ϸ��ֺ�ʹ��ͭ��ͭ������Ĺ���֮һ��ֱ������ͭ���仯�����ڹ�ũҵ��������Ȼ���Ź㷺��Ӧ�ã�


 A��B��C��D��E��H��I�����ɶ�����Ԫ����ɵ���ѧ�������ʣ�B��D��E��GΪ���ʣ�F��һ�ֳ����Ľ��������AΪ�ȼҵ�IJ���֮һ��BԪ���ǵؿ��к�����ߵĽ���Ԫ�أ�C��һ����ɫ��ζ��Һ�壬D��һ��������Դ���ʣ���Щ���ʵ�ת����ϵ���£���Ӧ��������ȥ����Ӧ���������ﶼ�ѱ�����ͼ�У���
A��B��C��D��E��H��I�����ɶ�����Ԫ����ɵ���ѧ�������ʣ�B��D��E��GΪ���ʣ�F��һ�ֳ����Ľ��������AΪ�ȼҵ�IJ���֮һ��BԪ���ǵؿ��к�����ߵĽ���Ԫ�أ�C��һ����ɫ��ζ��Һ�壬D��һ��������Դ���ʣ���Щ���ʵ�ת����ϵ���£���Ӧ��������ȥ����Ӧ���������ﶼ�ѱ�����ͼ�У���
