
【题目】关于如图所示的原电池,下列说法正确的是

A.该装置能将电能转化为化学能
B.锌片上发生还原反应
C.电子由锌片通过导线流向铜片
D.铜片上发生的反应为Cu2++2e-=Cu
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.NH4Cl晶体中只有离子键
B.液态HI受热分解的过程中,只破坏分子间作用力
C.Si3N4和CCl4均属于原子晶体
D.C4H10的2种同分异构体因为分子间作用力大小不同,因而沸点不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
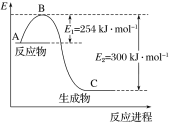
(1)上图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:______________。
(2)若已知下列数据:
化学键 | H—H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N—H的键能:________ kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-a kJ·mol-1①
N2(g)+O2(g)===2NO(g) ΔH2=-b kJ·mol-1②
若1 mol NH3还原NO至N2,则该反应过程中的反应热ΔH3=________ kJ·mol-1(用含a、b的式子表示)。
(4)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) ![]() (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) ![]() NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3与ΔH1、ΔH2之间的关系是ΔH3=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如下图所示,则下列叙述正确的是

A.b、c两点溶液的导电能力相同
B.a、b、c三点溶液中水的电离程度a>c>b
C.c点溶液中c(H+) =c(OH-) +c(CH3COOH)
D.用等浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸体积 Vb = Vc
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)在化工、医药、农药等方面有广泛的应用。
⑴甲醇脱氢法可制备甲醛,反应方程式为CH3OH![]() HCHO+H2。
HCHO+H2。
①发生反应时的过程如图所示,从热效应角度判断,可知该反应为______反应。

②下列方法中能减慢反应速率的是______(填字母)。
a.使用催化剂 b.升高温度 c.降低反应物浓度
③使用催化剂________(填“能”或“不能”)使反应物的转化率达到100%。
⑵甲醛超标会危害人体健康,需对甲醛含量检测及处理。
①某甲醛气体探测仪利用燃料电池工作原理,其结构如图所示。电极a为______(填“正”或“负”)极,在电极b上发生的反应类型为______反应。(填“氧化”或“还原”)

②探测仪工作时,电子从______极流出(填“a”或“b”),总反应方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组有机物,无论以何种物质的量的比例混合,只要总物质的量一定,则完全燃烧消耗氧气的量为一恒定值的是( )
A.C6H14和C7H14O3B.C2H6O和C2H4C.C5H8和C6H6D.C2H6和C3H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活息息相关。现有下列4种有机物:①乙炔 ②乙二醇 ③甲苯 ④苯酚,请将相应的序号填入空格内。
(1)用做汽车防冻剂的是___;
(2)可用于杀菌消毒、制造阿司匹林等,俗称石炭酸的是___;
(3)常用来焊接或切割金属的是___。
(4)制造烈性炸药TNT的化学方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是短周期元素,其部分性质如下表:
W | 单质是淡黄色固体 |
X | 在地壳中的含量居第二位 |
Y | 原子最外层电子数是电子总数的 |
Z | 第三周期原子半径最小的金属元素 |
下列说法正确的是
A. 气态氢化物的热稳定性:X>W B. Z的氧化物中含有非极性共价键
C. 离子半径:Z>W D. 最高价氧化物对应水化物的酸性:Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与电化学和金属的防护密切相关。请回答下列问题:
(1)将反应2Ag++Cu = 2Ag+Cu2+ 反应设计成如图所示的原电池.

则Ag 发生的反应是_______反应(填“氧化”、“还原”),X极的电极反应式为_______,该电池放电时,盐桥中的NO3-离子将移向_________溶液。如果将盐桥换成Cu条,则甲池为__________池(装置),X的电极名称是_________。
(2)铅蓄电池是当今生活中应用比较广泛的一种可充电电池,总反应式为:Pb+PbO2+2H2SO4 ![]() 2PbSO4 +2H2O。放电时,负极反应式为_______________;充电时,铅蓄电池的正极应与直流电源的________极相连,该电极的电极反应式为_____。
2PbSO4 +2H2O。放电时,负极反应式为_______________;充电时,铅蓄电池的正极应与直流电源的________极相连,该电极的电极反应式为_____。
(3)金属的防护方法有多种。如图是模拟铁的电化学防护。若X为碳棒,为减缓腐蚀,开关K应置于________处;反应的总反应离子方程式为______________,若X为锌,开关K置于M处,该电化学防护法称为_______________。
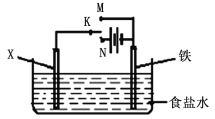
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com