
【题目】下列说法正确的是
A.NH4Cl晶体中只有离子键
B.液态HI受热分解的过程中,只破坏分子间作用力
C.Si3N4和CCl4均属于原子晶体
D.C4H10的2种同分异构体因为分子间作用力大小不同,因而沸点不同
科目:高中化学 来源: 题型:
【题目】黄铁矿石是制取硫酸的主要原料,主要成分为FeS2和少量FeS(假设其它杂质中不含铁、硫元素,且高温下不发生化学变化)。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m1g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为4FeS2+11O2=2Fe2O3+8SO2,4FeS+7O2=2Fe2O3+4SO2

(1)鼓人空气的作用是___________,锥形瓶乙中NaOH溶液的作用是___________。
(实验一)测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:

(2)反应结束后,给乙瓶溶液中加入足量H2O2溶液的目的是___________(用化学方程式表示)。
(3)洗涤滤渣的方法是______________________。
(4)该黄铁矿石中硫元素的质量分数为___________(列出表达式即可)。
(实验二)测定铁元素的含量
①用足量稀硫酸溶解石英管中的固体残渣;②加还原剂使溶液中的Fe3+恰好完全转化为Fe2+后,过滤、洗涤;③将滤液稀释至250mL;④取25.00mL稀释液,用0.1000mol·L-1的酸性KMnO4溶液滴定,三次滴定实验,平均消耗酸性KMnO4溶液25.00mL。
(5)操作②中用铁粉作还原剂,测定铁的含量___________(填“偏高”或“偏低”或“不变”),操作④中滴定时酸性KMnO4溶液盛装在___________填“酸式滴定管”或“碱式滴定管”),③中稀释液中Fe2+的物质的量浓度c(Fe2+)=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以链烃A为原料合成两种高分子材料的路线如下图所示:

已知以下信息:①分子式A(C6H14)、B(C6H12) 、C(C6H6) 、D(C6H5Cl) 、E(C8H10) 、F(C8H8)
②B(C6H12)的核磁共振氢谱中只有1组峰,G为一氯代烃;
③R1-X+R2-X ![]() R1- R2 (X代表卤素原子,R1、R2代表烃基)。
R1- R2 (X代表卤素原子,R1、R2代表烃基)。
④![]()
![]()
![]() +R3-COOH(R1、R2、R3代表烃基)。
+R3-COOH(R1、R2、R3代表烃基)。
请回答以下问题:
(1) B的化学名称为______________________。
(2)由G生成H的化学方程式为_____________________。
(3)由C生成D的反应类型为_____________。
(4)F的结构简式为_________________。
(5)I的同分异构体中能同时满足下列条件的共有____________种(不含立体异构)。
①能与饱和NaHCO3溶液反应产生气体;②既能发生银镜反应,又能发生水解反应。其中核磁共振氢谱中有4组峰,且峰面积之比为6:2:1:1的是________(写出其中一种的结构简式)。
(6)参照上述合成路线,以2-甲基己烷和一氯甲烷为原料(无机试剂任选),设计制备化合物E的合成路线___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作(或装置)与相关叙述正确的是
|
|
|
|
A.配制0.10mol·L-1NaOH溶液 | B.向碘水中加入苯后振荡、静置 | C.实验室制取少量氯气 | D.实验室制取少量乙酸乙酯 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R为前四周期元素,原子序数依次增大。X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素;R+离子的3d轨道全充满。请回答下列问题:
(1)Z3+离子的核外电子排布式是_______。
(2)科学家成功地在高压下将XY2转化为具有类似SiO2结构的原子晶体,该晶体中X原子的杂化轨道类型是_______;X、Z、R的单质分别与足量Y2充分反应所得产物的熔点由高到低的顺序是_______。(填化学式)
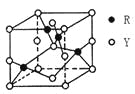
(3)由Y、R形成的某化合物的晶胞结构如图所示,其化学式是_______。
(4)常温下,pH相同的NaZY2与Na2XY3两种溶液,物质的量浓度较大的是_______。(填化学式)
(5)将亚硫酸钠的水溶液逐滴加入RCl2的水溶液中,再加入少量浓盐酸混匀,得到难溶的白色沉淀RCl,该反应的离子方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
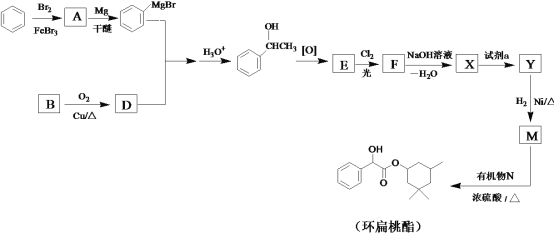
【题目】环扁桃酯是用于治疗心脑血管疾病的重要化合物,它的一种合成路线如图。
已知:RX![]() R-MgX
R-MgX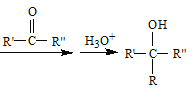 (R、R’、R”代表烃基或氢)
(R、R’、R”代表烃基或氢)
(1)A的结构简式是___。
(2)B→D的化学方程式是___。
(3)红外吸收光谱表明E有C=O键。F的分子式为C8H6Cl2O。
①E的结构简式是___。
②E→F的反应类型是___。
(4)X的结构简式是___。
(5)试剂a是___。
(6)生成环扁桃酯的化学方程式是___。
(7)以CH3CH=CH2、CH3CHO为有机原料,结合题目所给信息,选用必要的无机试剂合成CH2=CHCH=CH3,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D四种物质都是气体,现在5L的密闭容器中进行反应:4A+5B![]() 4C+6D,30s后C的物质的量增加了0.30mol。则下列有关叙述正确的是( )
4C+6D,30s后C的物质的量增加了0.30mol。则下列有关叙述正确的是( )
A.反应开始至30s,v(A)=0.010mol·L-1·s-1
B.30s时容器中D的物质的量至少为0.45mol
C.30s时容器中A、B、C、D的物质的量之比一定是4∶5∶4∶6
D.反应开始至30s,容器中A的物质的量增加了0.30mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.甲硅烷(SiH4)常温下是一种无色气体,遇空气发生自燃。
(1)甲硅烷中含有的化学键是___,其在固态时属于___晶体。
(2)室温下1g甲硅烷燃烧生成SiO2和H2O放热44.6kJ,其热化学方程式为___。
Ⅱ.①CaCO3(s)=CaO(s)+CO2(g) △H=178.2kJmol-1
②2Na(s)+Cl2(g)=2NaCl(s) △H=-822.0kJmol-1
则:
(3)上述反应①②中属于放热反应的是___(填序号)。
(4)根据②计算生成1molNaCl(s)时,△H=___kJmol-1
Ⅲ.氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图。该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:
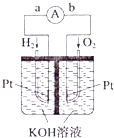
(5)氢氧燃料电池的能量转化形式主要是___。在导线中电子流动方向为___(用a、b表示)。
(6)负极反应式为___。
(7)金属锂是一种重要的储氢材料,吸氢和放氢原理如下:2Li+H2=2LiH,LiH+H2O=LiOH+H2↑,则2mol锂储氢后释放出的H2可以消耗标准状态O2的体积是___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示的原电池,下列说法正确的是

A.该装置能将电能转化为化学能
B.锌片上发生还原反应
C.电子由锌片通过导线流向铜片
D.铜片上发生的反应为Cu2++2e-=Cu
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com