
����Ŀ��I��һ����Ҫ���л��������ϳ�·����ͼ��ʾ��
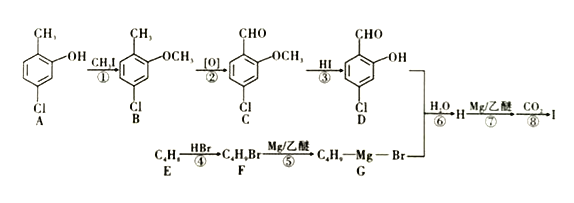
��֪��
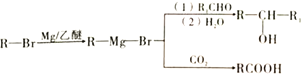
���л���F�ṹ��ֻ��һ�ֵ�Ч�⣻
��
�Ը������֪ʶ�ش��������⣺
��1����E������Ϊ_________������B���еĹ����ŵ�����Ϊ________��B��C�ķ�Ӧ������_________��
��2���ڸù����в����٢�������Ƶ�Ŀ����_______________________�����Ҫ����ϳɵĻ�����B���Ƿ���Aʱ������_______�Լ���
��3��C�������Ƶ�Cu(OH)2��Ӧ����ש��ɫ��������д���÷�Ӧ�Ļ�ѧ����ʽ��_____________________��������I�Ľṹ��ʽΪ_____________________________��
��4�������廯����M(C8H7O2Br)�ܷ���������Ӧ���ұ�����ֻ������ȡ��������������������ͬ���칹��һ����_______�֡�(��ʾ��������-O-Br���ṹ�����ʲ��ȶ���������)
��5�����������ϳ�·�ߣ����Ҵ�Ϊ����ԭ��(�����Լ���ѡ)������Ʊ�CH3CH2COOCH2CH3�ĺϳ�·�ߡ�______________
���𰸡� 2-����ϩ ��ԭ�ӡ��Ѽ� ������Ӧ �����ǻ��ڵڢڲ��в������� ��ˮ��FeCl3��Һ  +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH![]()
 +Cu2O��+3H2O
+Cu2O��+3H2O  21 CH3CH2OH
21 CH3CH2OH![]() CH3CH2Br
CH3CH2Br![]() CH3CH2COOH
CH3CH2COOH![]() CH3CH2COOCH2CH3
CH3CH2COOCH2CH3
���������л���F�ṹ��ֻ��һ�ֵ�Ч�⣬���F�ķ���ʽC4H9Br����֪F�к���3������FΪCBr(CH3)3����EΪCH2=C(CH3)2��GΪC(CH3)3MgBr��������Ϣ�ڣ�HΪ ��IΪ
��IΪ ��
��
(1)��EΪCH2=C(CH3)2������Ϊ2-����ϩ������B�� �����еĹ���������ԭ�ӡ��Ѽ���B��
�����еĹ���������ԭ�ӡ��Ѽ���B�� ���б����ϵļ�����������C��
���б����ϵļ�����������C�� �����ʴ�Ϊ��2-����ϩ����ԭ�ӡ��Ѽ���������Ӧ��
�����ʴ�Ϊ��2-����ϩ����ԭ�ӡ��Ѽ���������Ӧ��
(2)��������ͼ���ڸù����в���٢�������Ƶ�Ŀ���DZ����ǻ��ڵ������в������������Ҫ����ϳɵĻ�����B���Ƿ���Aʱ��ֻ��Ҫ�����Ƿ��зӼ��ɣ�����ѡ����ˮ��FeCl3��Һ������ˮ�����Կ������ɰ�ɫ��������FeCl3��Һ�����Կ�����Һ�����ɫ���ʴ�Ϊ�������ǻ��ڵ������в�����������ˮ��FeCl3��Һ��
(3)C�� ���к���ȩ�����������Ƶ�Cu(OH)2��Ӧ����ש��ɫ��������Ӧ�Ļ�ѧ����ʽΪ
���к���ȩ�����������Ƶ�Cu(OH)2��Ӧ����ש��ɫ��������Ӧ�Ļ�ѧ����ʽΪ +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH![]()
 +Cu2O��+3H2O����������������������I�Ľṹ��ʽΪ
+Cu2O��+3H2O����������������������I�Ľṹ��ʽΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH![]()
 +Cu2O��+3H2O��
+Cu2O��+3H2O�� ��
��
(4)�����廯����M(C8H7O2Br)�ܷ���������Ӧ��˵���ṹ�к��б�����ȩ����������ֻ������ȡ����������������ͬ���칹���У��ٱ����Ϻ��С�Br�͡�CH2OCHO��3�֣��ڱ����Ϻ��С�Br�͡�CH��OH��CHO��3�֣��۱����Ϻ��С�Br��HCOOCH2����3�֣��ܱ����Ϻ��С�CHO�͡�CHBrOH��3�֣��ݱ����Ϻ��С�CH2Br��HCOO����3�֣��ޱ����Ϻ��С�OH�͡�CHBrCHO��3�֣��߱����Ϻ��С�CHBrOH�͡�CHO��3�֣���21�֣��ʴ�Ϊ��21��
(5)���Ҵ�Ϊԭ���Ʊ�CH3CH2COOCH2CH3����Ҫ�Ⱥϳ�CH3CH2COOH�����������Ϣ�����Խ�CH3CH2OH�����廯��ȡ�����������飬Ȼ�������龭����Ϣ��ת��ΪCH3CH2COOH��������Ҵ��������ɣ��ϳ�·��ΪCH3CH2OH![]() CH3CH2Br
CH3CH2Br![]() CH3CH2COOH
CH3CH2COOH![]() CH3CH2COOCH2CH3���ʴ�Ϊ��CH3CH2OH
CH3CH2COOCH2CH3���ʴ�Ϊ��CH3CH2OH![]() CH3CH2Br
CH3CH2Br![]() CH3CH2COOH
CH3CH2COOH![]() CH3CH2COOCH2CH3��
CH3CH2COOCH2CH3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ����Ҫ�Ĺ���Ԫ�أ�������ƻ������������Ҫ���ϣ������ƾ���(Na2MoO4��2H2O)��һ����Ҫ�Ľ�����ʴ����ij�����������(��Ҫ�ɷ�MoS2)Ϊԭ��ұ��������������ƾ������Ҫ����ͼ���£�
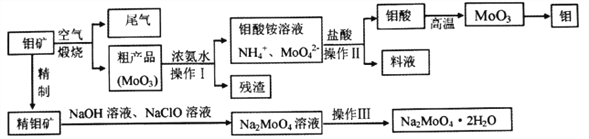
��1��Na2MoO4��2H2O��Ԫ�صļ�̬Ϊ_________����ҵ��������β���ù����İ�ˮ��������Ӧ�����ӷ���ʽΪ________________________________________________��
��2����ͼ����Ϣ�����ж�MoO3��____________�����(������������������������������)
��3������ NaClO���������ķ�������ʯ�е���������ù��̷��ȣ��仯ѧ��ӦΪ��NaClO+MoS2+NaOH��Na2MoO4+Na2SO4+NaCl+H2O���÷�Ӧ��ƽ�� NaClO��MoS2��ϵ����Ϊ____________�������¶����ߣ���Ľ����ʵı仯��ͼ������50��������ʽ��͵Ŀ���ԭ����____________________________________(д����)��
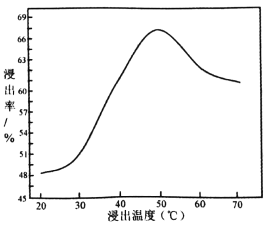
��4����������Ҫ����____________�����������õ�����Ҫˮϴ�����������Ƿ�ϴ�Ӹɾ��ķ�����____________________________________��
��5��﮺�MoS2�ɳ���صĹ���ԭ��ΪxLi+nMoS2![]() Li(MoS2)n�����س��ʱ�����ϵĵ缫��ӦʽΪ______________________��
Li(MoS2)n�����س��ʱ�����ϵĵ缫��ӦʽΪ______________________��
��6��ij������1.00��103�ִ����(��MoS216.00%)�Ʊ��ⵥ�ʣ���֪ұ�������У���������Ϊ10.00%�������յõ��ⵥ������Ϊ___________�֡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ڱ仯�����У�ֻ��˷����Ӽ�����������
A.ʳ���ۻ�B.�ɱ�����
C.�Ȼ�����ȣ�������ʧD.�Ȼ�������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����и������ʣ�
A.���ʯ��ʯī��B.��������ά�أ�C.���뮣�D.���������飻E.�����������
F.  G.
G. 
���л�Ϊͬλ�ص���____________�����ţ���ͬ������Ϊͬϵ�����_______����Ϊͬ���칹�����__________����ͬһ�����ʵ���_____________��
��2��������A�Ľṹ��ʽΪ�� ����������ȼ��Ʒ�ʿ������ܵIJ��������A��ͬ���칹���к���ԭ���������ٵ�һ�ֽṹ��ʽΪ��__________����A����ϩ����H2ͨ���ӳɷ�Ӧ�õ���д����ϩ�������п��ܵĽṹ��ʽ__________��
����������ȼ��Ʒ�ʿ������ܵIJ��������A��ͬ���칹���к���ԭ���������ٵ�һ�ֽṹ��ʽΪ��__________����A����ϩ����H2ͨ���ӳɷ�Ӧ�õ���д����ϩ�������п��ܵĽṹ��ʽ__________��
��3��������ӵļ���ʽ��ͼ��ʾ���Իش�
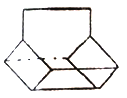
��д��������ӵĻ�ѧʽ____________��
��������ӵ�һ��ȡ���������Ϊ_______�֡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ԡ���ԭ�Ե�ǿ�������������ʵĽṹ�йأ��������ʵ�Ũ�Ⱥͷ�Ӧ�¶��йء����и��������ڷ�Ӧ�еIJ��������ʵ�Ũ���йص���(����)
��Cu��HNO3��Һ����Cu��FeCl3��Һ����Zn��H2SO4��Һ����Fe��HCl��Һ
A.�٢�
B.�ۢ�
C.�٢�
D.�٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ�������ѧ�ͻ���������ʳƷӪ��������Ӧ�õ�������ء�
��1�����λ�����Ⱦ��Ӫ�찲ȫ����̬�����ѳ�Ϊȫ����Ĺ�ʶ��
����Ȼˮ�����ʽ϶࣬��������������Ȼ����������������д���������������ˮ�����ɵĽ����������ˮ�е����������������Ȼ���Ϊ���������ӷ���ʽ��ʾ�þ�ˮԭ��_________��
����������Ҫ��ѭ��������������________��ԭ��
��������β��ϵͳ��װ�ô�ת���������ں�Ǧ�������ʹ____________������װ�д�ת��������������ʹ����Ǧ���͡�
��2����֤ʳƷ��ҩƷ��ȫ������Ӫ�����⣬�����彡���Ļ�����
��������Ҫ��Ӫ������Ҫ�����ࡢ��֬�������ʡ�________��ά���غ�ˮ�����⡢���������ȡ����⼸��Ԫ���У���������������������Ԫ����________��
������ҩ�������ܶ࣬����Ч�ɷ�һ�㶼��̼�����ơ�̼��ơ�̼��þ������������������þ�Ȼ�ѧ���ʡ�ijƷ�ƿ���ҩ����Ҫ�ɷ������¡�̼��þ�����ۡ�д���ÿ���ҩ���ӹ�Чʱ�����ӷ���ʽ��__________________________��
�������ע���������ʳ������룬�ͻᵼ��ѪҺƫ�ᣬ�����γɡ�________֢������������ȱ�ơ�ѪҺ������ȡ�
��Ư�ۿ�����������ˮ��ɱ����������ҵ������������ʯ������ȡƯ�۵Ļ�ѧ��Ӧ����ʽ��____________________________��
��3���ḻ��ʵIJ���Ϊ���������ͷ�չ����������������������
ʯӢ��������Ҫ�ɷ�Ϊ____________(�ѧʽ)���л���������ʱ�����������ڼӹ����͡��л�������һ��____________(ѡ��������������ά������������)����Щ����ֻ�����������������ʱ�ܱ������������Ƴ�һ������״�����ӹ����ͺ�Ͳ��������ۻ�������__________������������̥����Ҫԭ�ϣ���Ȼ��ͨ��������ʹ���ķ���ת��Ϊ__________�ṹ���Ӷ�������ǿ�ȡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��0.1mol/L��HA��Һ�� ![]() =1010 �� 0.01mol/L��BOH��ҺpH=12����ش��������⣺
=1010 �� 0.01mol/L��BOH��ҺpH=12����ش��������⣺
��1��HA��________���ǿ����ʡ���������ʡ�����ͬ����BOH��________��
��2��HA�ĵ��뷽��ʽ��________��������ˮ�������c��H+��=________mol/L��
��3���ڼ�ˮϡ��HA�Ĺ����У�����ˮ�������Ӷ���С����_______������ĸ����
A.![]() B.
B.![]() C.c��H+����c��OH�����ij˻�D.c��OH����
C.c��H+����c��OH�����ij˻�D.c��OH����
��4��������������ʵ���Ũ�ȵ�HA��Һ��BOH��Һ��Ϻ����Һ��________�ԣ��������ӷ���ʽ������ԭ��_______________________�������Һ�и�����Ũ���ɴ�С��˳����_______________________��
��5��������pH=12��BOH��Һ100mL����0.01mol/L NaHSO4ʹ��Һ��pHΪ11���������Һ����仯���Բ��ƣ���Ӧ�� NaHSO4________mL����������С�����һλ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʮ�����Ӻ�ˮ��Դ���ۺ����ã�����Ҫ��ѧ�仯���ܴӺ�ˮ�л�õ�������
A. �塢�� B. �ơ�þ C. �ռ���� D. ʳ�Ρ���ˮ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com