
【题目】钼是一种重要的过渡元素,钼钢是制火箭发动机的重要材料,钼酸钠晶体(Na2MoO4·2H2O)是一种重要的金属缓蚀剂。某工厂利用钼矿(主要成分MoS2)为原料冶炼金属钼和钼酸钠晶体的主要流程图如下:
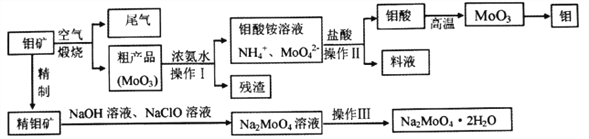
(1)Na2MoO4·2H2O中元素的价态为_________,工业煅烧钼矿的尾气用过量的氨水处理,反应的离子方程式为________________________________________________。
(2)由图中信息可以判断MoO3是____________氧化物。(填“酸性”、“碱性”或“两性”)
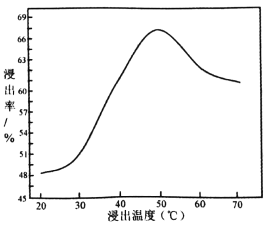
(3)采用 NaClO氧化精钼矿的方法将矿石中的钼浸出,该过程放热,其化学反应为:NaClO+MoS2+NaOH→Na2MoO4+Na2SO4+NaCl+H2O,该反应配平后, NaClO与MoS2的系数比为____________。随着温度升高,钼的浸出率的变化如图,高于50℃后浸出率降低的可能原因是____________________________________(写两点)。
(4)操作Ⅲ主要包括____________,操作Ⅱ所得的钼酸要水洗,检验钼酸是否洗涤干净的方法是____________________________________。
(5)锂和MoS2可充电电池的工作原理为xLi+nMoS2![]() Li(MoS2)n,则电池充电时阳极上的电极反应式为______________________。
Li(MoS2)n,则电池充电时阳极上的电极反应式为______________________。
(6)某工厂用1.00×103吨粗钼矿(含MoS216.00%)制备钼单质,已知冶炼过程中,钼的损耗率为10.00%,则最终得到钼单质质量为___________吨。
【答案】 +6 SO2+2NH3·H2O=2NH4++SO32-+H2O 酸性 9∶1 随着温度升高,其它金属杂质离子浸出也增多,沉淀了MoO42;该反应为放热反应,升温使平衡逆移;NaClO不稳定,随温度升高而分解损耗。 蒸发浓缩、降温结晶、过滤 取水洗液少量于试管中,加入AgNO3溶液,若无沉淀产生即证明钼酸已洗净 Lix(MoS2)n-xe-=nMoS2+xLi+ 86.4
【解析】(1)Na2MoO4·2H2O中Na为+1价,O为-2价,所以Mo为+6价;根据题意可知工业煅烧钼矿的尾气为二氧化硫,用氨水吸收的离子方程式为:SO2+2NH3·H2O=2NH4++SO32-+H2O
(2)由图中信息可知MoO3可以与氨水反应生成MoO42-,所以是酸性氧化物;
(3)利用化合价升降法配平NaClO中Cl的化合价由+1变为-1,MoS2中Mo的化合价由+4变为+6,S由-1变为+6,配平后的方程式为:9NaClO+MoS2+6NaOH=Na2MoO4+2Na2SO4+9NaCl+3H2O,所以NaClO与MoS2的系数比为9:1;随着温度升高,其它金属杂质离子浸出也增多,沉淀了MoO42;该反应为放热反应,升温使平衡逆移;NaClO不稳定,随温度升高而分解损耗。
(4)操作Ⅲ的目的是让溶液中析出晶体,操作应该是:蒸发浓缩、降温结晶、过滤;检验钼酸是否洗涤干净可以检验洗涤液中中是否含有氯离子,具体操作为:取水洗液少量于试管中,加入AgNO3溶液,若无沉淀产生即证明钼酸已洗净。
(5)电池充电时为电解池,阳极上应该发生失电子的反应,所以电极反应为:Lix(MoS2)n-xe-=nMoS2+xLi+;
(6)根据题意列出计算式![]() ,故最终得到的钼单质质量是86.4吨。
,故最终得到的钼单质质量是86.4吨。


科目:高中化学 来源: 题型:
【题目】据报道,我国华为公司的技术标准成为世界“5G”通讯标准的重要组成部分。随着“5G”时代的逐渐到来,以光导纤维为基础的信息高速通道更显重要。制造光导纤维的材料是( )
A.铜合金B.橡胶C.不锈钢D.二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠是日常生活的必需品,也是重要的化工原料。
(1)粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是粗盐提纯的操作流程。

提供的试剂:
Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液。
①欲除去溶液I中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、_____________、_____________;
②用离子方程式表示加盐酸的作用是________________;_______________________;
(2)实验所得纯NaCl的质量大于粗盐中NaCl的质量,原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子反应、氧化还原反应都是中学化学中重要的反应类型。请回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在有_____________。
A.单质 B.氧化物 C.电解质 D.盐 E.化合物
(2)人们常用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。右图为离子反应、氧化还原反应和置换反应三者之间的关系,则表示离子反应、氧化还原反应、置换反应的字母依次是_____________

(3)将NaBr溶液加入AgC1沉淀中,产生AgBr黄色沉淀。从离子反应发生的条件分析,AgCl与AgBr相比较,溶解度较大的是_____________。
(4)已知某氧化还原反应Au2O3 + 4Na2S2O3 + 2H2O =Au2O+ 2Na2S4O6 +4NaOH
① 用单线桥标出电子转移的方向和数目________________。
② 反应中,被氧化的元素是______________,氧化剂是_________________。
③ 比较该反应中氧化剂和氧化产物的氧化性相对强弱_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-Q kJ/mol(Q>0)
2NH3(g) ΔH=-Q kJ/mol(Q>0)
据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K=________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越________。
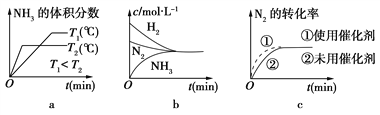
(2)对于合成氨反应而言,下列有关图像一定正确的是(选填序号)________。
(3)某温度下,若把2 mol N2与6 mol H2置于体积为1 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K=________(可用分数表示)。
(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a________b(填“>”、“=”或“<”,下同),Q1________Q2,Q1_______Q。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要90 mL 3.0mol·L-1 稀硫酸溶液,某同学用质量分数为98%,密度为1.84g/cm3的浓硫酸配制。实验操作如下:
A.将配好的稀硫酸倒入试剂瓶中,贴好标签;
B.盖好容量瓶塞,反复颠倒,摇匀;
C.用量筒量取 mL98%的浓硫酸;
D.将______________沿烧杯内壁慢慢注入盛有少量______________的烧杯中;
E.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液也全部转移到容量瓶中;
F.将已冷却至室温的硫酸溶液沿玻璃棒注入 ;
G.改用 逐滴加蒸馏水,使溶液凹面恰好与刻度相切;
H.继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2 cm处。
(1)填写上述步骤中的空白:
C:________ ;D :将________ 注入________ ;F:________ ;G:_______ 。
(2)将上面操作步骤按正确的进行排序______________(用字母表示)。
(3)试分析下列操作会使所配溶液的浓度偏高的是______________(填序号)。
① 量取浓硫酸时俯视读数;
② 转移溶液前,容量瓶中含有少量蒸馏水;
③ 溶解硫酸用的烧杯、玻璃棒未洗涤;
④ 未冷却至室温定容;
⑤ 定容时俯视容量瓶的刻度线;
⑥ 定容后摇匀,发现液面低于刻度线,再滴加蒸馏水至刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组拟提纯粗盐并取苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程:

请根据上述流程,回答以下问题:
(1)要从橙红色液体中分离出溴,可采取的操作是____________。
(2)试剂A中如果有两种溶质,它们是_____ 、 ______;如果是一种溶质,它是________。试剂B是__________。
(3)检验SO42- 已除尽的方法是__________________________________________。
(4)操作②名称_______________。
(5)在操作②之后的无色溶液中加入稀盐酸的目的是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I是一种重要的有机化合物,其合成路线如图所示:
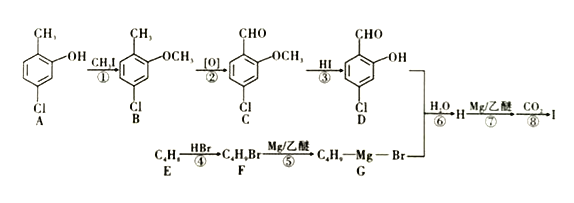
已知:
①有机物F结构中只有一种等效氢;
②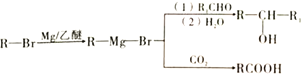
试根据相关知识回答下列问题:
(1)烃E的名称为_________,物质B含有的官能团的名称为________,B到C的反应类型是_________。
(2)在该过程中步骤①③两步设计的目的是_______________________,如果要检验合成的化合物B中是否含有A时,可用_______试剂。
(3)C能与新制的Cu(OH)2反应生成砖红色沉淀,试写出该反应的化学方程式:_____________________,化合物I的结构简式为_____________________________。
(4)芳香族化合物M(C8H7O2Br)能发生银镜反应,且苯环上只有两个取代基,满足上述条件的同分异构体一共有_______种。(提示:含有“-O-Br”结构的物质不稳定,不考虑)
(5)参照上述合成路线,以乙醇为基本原料(其他试剂自选),设计制备CH3CH2COOCH2CH3的合成路线。______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com