
【题目】合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-Q kJ/mol(Q>0)
2NH3(g) ΔH=-Q kJ/mol(Q>0)
据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K=________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越________。
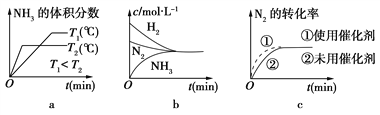
(2)对于合成氨反应而言,下列有关图像一定正确的是(选填序号)________。
(3)某温度下,若把2 mol N2与6 mol H2置于体积为1 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K=________(可用分数表示)。
(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a________b(填“>”、“=”或“<”,下同),Q1________Q2,Q1_______Q。
【答案】 ![]() 小 a、c 1/48 < < <
小 a、c 1/48 < < <
【解析】试题分析:(1)①化学平衡常数=![]() ;②该反应放热,升高温度平衡逆向移动;(2)该反应放热,升高温度平衡逆向移动,温度越高氨气的体积分数越小;达到平衡时氮气、氢气、氨气的浓度不一定相等;加入催化剂能加快反应速率,但平衡不移动;(3)利用“三段式”计算平衡常数;(4)合成氨反应,气体系数和减小,恒压密闭容器与恒容密闭容器相比,恒压密闭容器相当于加压;
;②该反应放热,升高温度平衡逆向移动;(2)该反应放热,升高温度平衡逆向移动,温度越高氨气的体积分数越小;达到平衡时氮气、氢气、氨气的浓度不一定相等;加入催化剂能加快反应速率,但平衡不移动;(3)利用“三段式”计算平衡常数;(4)合成氨反应,气体系数和减小,恒压密闭容器与恒容密闭容器相比,恒压密闭容器相当于加压;
解析:(1)①N2(g)+3H2(g) ![]() 2NH3(g) 化学平衡常数表达式
2NH3(g) 化学平衡常数表达式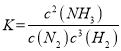 ;②该反应放热,升高温度平衡逆向移动,所以温度越高,其平衡常数的值越小;(2)该反应放热,升高温度平衡逆向移动,温度越高氨气的体积分数越小,根据图像a,
;②该反应放热,升高温度平衡逆向移动,所以温度越高,其平衡常数的值越小;(2)该反应放热,升高温度平衡逆向移动,温度越高氨气的体积分数越小,根据图像a, ![]() ,
, ![]() 时氨气的体积分数减小,故a正确;达到平衡时氮气、氢气、氨气的浓度不一定相等,故b错误;加入催化剂能加快反应速率,但平衡不移动,故c正确;
时氨气的体积分数减小,故a正确;达到平衡时氮气、氢气、氨气的浓度不一定相等,故b错误;加入催化剂能加快反应速率,但平衡不移动,故c正确;
(3)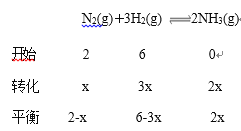
![]()
x=![]() ,
, 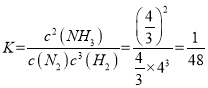 ;
;
(4)合成氨反应,气体系数和减小,恒压密闭容器与恒容密闭容器相比,恒压密闭容器相当于加压,加压平衡正向移动,所以a<b;生成氨气越多,放出的热量越多,所以Q1<Q2;反应可逆,所以1 mol N2和3 mol H2不能完全反应生成2mol氨气,所以Q1<Q。


科目:高中化学 来源: 题型:
【题目】下列关于Fe( OH)3胶体的说法中,不正确的是( )
A.分散质粒子直径在10﹣9~l0﹣7m之间
B.是一种纯净物
C.具有丁达尔效应
D.具有净水作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 水的离子积常数KW只与温度有关,但若外加酸、碱会抑制水的电离,若外加盐则可能促进水的电离或不影响水的电离。
B. Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关。
C. 常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH![]() )/c(NH3·H2O)的值增大,故使NH3·H2O的Kb会减小。
)/c(NH3·H2O)的值增大,故使NH3·H2O的Kb会减小。
D. 室温下,CH3COOH的Ka=1.7×10-5,NH3·H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3·H2O中的c(OH-)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50 mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10 mL,将其稀释至100 mL,并向此稀释后的溶液中逐滴加入0.1 mol·L-1盐酸,产生CO2气体的体积(标准状况下)与所加入盐酸的体积关系如下图所示。

(1) 写出OA段所发生反应的离子方程式:______________。
(2)NaOH在吸收CO2后,所得溶液的溶质为____,其物质的量浓度之比为____。
(3)产生CO2的体积(标准状况下)为____。
(4)原NaOH溶液的物质的量浓度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼是一种重要的过渡元素,钼钢是制火箭发动机的重要材料,钼酸钠晶体(Na2MoO4·2H2O)是一种重要的金属缓蚀剂。某工厂利用钼矿(主要成分MoS2)为原料冶炼金属钼和钼酸钠晶体的主要流程图如下:
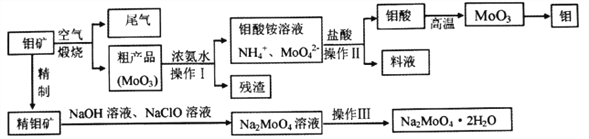
(1)Na2MoO4·2H2O中元素的价态为_________,工业煅烧钼矿的尾气用过量的氨水处理,反应的离子方程式为________________________________________________。
(2)由图中信息可以判断MoO3是____________氧化物。(填“酸性”、“碱性”或“两性”)
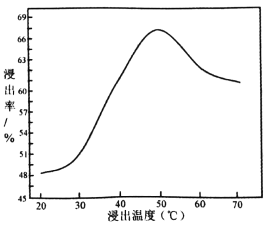
(3)采用 NaClO氧化精钼矿的方法将矿石中的钼浸出,该过程放热,其化学反应为:NaClO+MoS2+NaOH→Na2MoO4+Na2SO4+NaCl+H2O,该反应配平后, NaClO与MoS2的系数比为____________。随着温度升高,钼的浸出率的变化如图,高于50℃后浸出率降低的可能原因是____________________________________(写两点)。
(4)操作Ⅲ主要包括____________,操作Ⅱ所得的钼酸要水洗,检验钼酸是否洗涤干净的方法是____________________________________。
(5)锂和MoS2可充电电池的工作原理为xLi+nMoS2![]() Li(MoS2)n,则电池充电时阳极上的电极反应式为______________________。
Li(MoS2)n,则电池充电时阳极上的电极反应式为______________________。
(6)某工厂用1.00×103吨粗钼矿(含MoS216.00%)制备钼单质,已知冶炼过程中,钼的损耗率为10.00%,则最终得到钼单质质量为___________吨。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中,在金属元素与非金属元素的分界线附近可以找到( )
A.作为催化剂的材料B.电子工业上的半导体材料
C.制造农药的材料D.制造耐高温材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组物质:
A.金刚石与石墨;B.淀粉与纤维素;C.氕与氘;D.甲烷与戊烷;E.葡萄糖与果糖
F.  G.
G. 
其中互为同位素的是____________(填编号,下同);互为同系物的是_______;互为同分异构体的是__________;是同一种物质的是_____________。
(2)化合物A的结构简式为: ,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含氢原子种类最少的一种结构简式为:__________;若A是由烯烃和H2通过加成反应得到,写出该烯烃的所有可能的结构简式__________。
,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含氢原子种类最少的一种结构简式为:__________;若A是由烯烃和H2通过加成反应得到,写出该烯烃的所有可能的结构简式__________。
(3)篮烷分子的键线式如图所示,试回答:
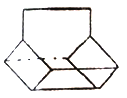
①写出篮烷分子的化学式____________;
②篮烷分子的一氯取代物的种数为_______种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com