
【题目】下列物质中,只含共价键的是
A.H2OB.NaOHC.KBrD.NH4NO3
科目:高中化学 来源: 题型:
【题目】向澄清饱和石灰水中通入二氧化碳,测得溶液导电性(I表示导电能力)的变化,以下与加入物质量的关系正确的是

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )

A. HA为强酸 B. 该混合液pH=7
C. 图中X表示HA,Y表示OH-,Z表示H+ D. 该混合溶液中:c(A—)+ c(Y)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠是日常生活的必需品,也是重要的化工原料。
(1)粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是粗盐提纯的操作流程。

提供的试剂:
Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液。
①欲除去溶液I中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、_____________、_____________;
②用离子方程式表示加盐酸的作用是________________;_______________________;
(2)实验所得纯NaCl的质量大于粗盐中NaCl的质量,原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图回答,下列说法正确的是
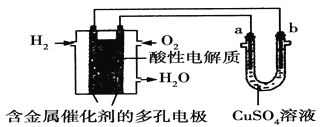
A. 此装置若用于铁表面镀铜时,a为铁。
B. 此装置若用于电镀铜时,硫酸铜溶液的浓度逐渐变小。
C. 燃料电池中正极反应为:O2+4e-+2H2O===4OH-
D. 若用该装置进行粗铜的精炼,当有1 mol水生成时,b电极上增重63.5 g,a电极下方有部分重金属泥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子反应、氧化还原反应都是中学化学中重要的反应类型。请回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在有_____________。
A.单质 B.氧化物 C.电解质 D.盐 E.化合物
(2)人们常用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。右图为离子反应、氧化还原反应和置换反应三者之间的关系,则表示离子反应、氧化还原反应、置换反应的字母依次是_____________

(3)将NaBr溶液加入AgC1沉淀中,产生AgBr黄色沉淀。从离子反应发生的条件分析,AgCl与AgBr相比较,溶解度较大的是_____________。
(4)已知某氧化还原反应Au2O3 + 4Na2S2O3 + 2H2O =Au2O+ 2Na2S4O6 +4NaOH
① 用单线桥标出电子转移的方向和数目________________。
② 反应中,被氧化的元素是______________,氧化剂是_________________。
③ 比较该反应中氧化剂和氧化产物的氧化性相对强弱_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-Q kJ/mol(Q>0)
2NH3(g) ΔH=-Q kJ/mol(Q>0)
据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K=________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越________。
(2)对于合成氨反应而言,下列有关图像一定正确的是(选填序号)________。
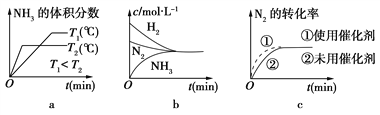
(3)某温度下,若把2 mol N2与6 mol H2置于体积为1 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K=________(可用分数表示)。
(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a________b(填“>”、“=”或“<”,下同),Q1________Q2,Q1_______Q。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组拟提纯粗盐并取苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程:

请根据上述流程,回答以下问题:
(1)要从橙红色液体中分离出溴,可采取的操作是____________。
(2)试剂A中如果有两种溶质,它们是_____ 、 ______;如果是一种溶质,它是________。试剂B是__________。
(3)检验SO42- 已除尽的方法是__________________________________________。
(4)操作②名称_______________。
(5)在操作②之后的无色溶液中加入稀盐酸的目的是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是
A.原子半径:Na>Si>ClB.还原性:Na>Mg>Al
C.稳定性:SiH4>H2S>HClD.酸性:H3PO4<H2SO4<HClO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com