
【题目】下列气体不会造成空气污染的是
A. SO2 B. CO C. O2 D. NO2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某元素的原子最外层只有一个电子,它跟VIIA族元素结合时形成的化学键
A.一定是共价键B.一定是离子键
C.可能是共价键,也可能是离子键D.上述说法都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼是一种重要的过渡元素,钼钢是制火箭发动机的重要材料,钼酸钠晶体(Na2MoO4·2H2O)是一种重要的金属缓蚀剂。某工厂利用钼矿(主要成分MoS2)为原料冶炼金属钼和钼酸钠晶体的主要流程图如下:
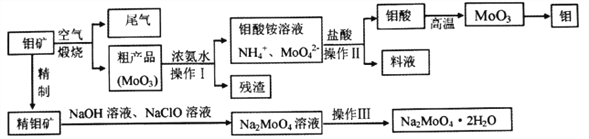
(1)Na2MoO4·2H2O中元素的价态为_________,工业煅烧钼矿的尾气用过量的氨水处理,反应的离子方程式为________________________________________________。
(2)由图中信息可以判断MoO3是____________氧化物。(填“酸性”、“碱性”或“两性”)
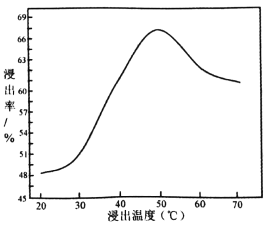
(3)采用 NaClO氧化精钼矿的方法将矿石中的钼浸出,该过程放热,其化学反应为:NaClO+MoS2+NaOH→Na2MoO4+Na2SO4+NaCl+H2O,该反应配平后, NaClO与MoS2的系数比为____________。随着温度升高,钼的浸出率的变化如图,高于50℃后浸出率降低的可能原因是____________________________________(写两点)。
(4)操作Ⅲ主要包括____________,操作Ⅱ所得的钼酸要水洗,检验钼酸是否洗涤干净的方法是____________________________________。
(5)锂和MoS2可充电电池的工作原理为xLi+nMoS2![]() Li(MoS2)n,则电池充电时阳极上的电极反应式为______________________。
Li(MoS2)n,则电池充电时阳极上的电极反应式为______________________。
(6)某工厂用1.00×103吨粗钼矿(含MoS216.00%)制备钼单质,已知冶炼过程中,钼的损耗率为10.00%,则最终得到钼单质质量为___________吨。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用H++OH﹣=H2O来表示的化学反应是( )
A.氢氧化镁和稀盐酸反应
B.Ba(OH)2溶液滴入稀硫酸中
C.澄清石灰水和稀硝酸反应
D.二氧化碳通入澄清石灰水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中,在金属元素与非金属元素的分界线附近可以找到( )
A.作为催化剂的材料B.电子工业上的半导体材料
C.制造农药的材料D.制造耐高温材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生以酚酞为指示剂用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,三次实验分别记录有关数据如下表:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 25.00 | 0.00 | 27.45 |
第二次 | 25.00 | 0.00 | 30.30 |
第三次 | 25.00 | 0.00 | 27.55 |
下列说法正确的是:
A. 当溶液从无色刚好变成红色时,则滴定终点达到
B. 该氢氧化钠溶液中c(NaOH)=0.110 0 mol·L-1
C. .滴定达终点时,滴定管尖嘴有悬液,则测定结果偏低
D. 实验中锥形瓶应用待测氢氧化钠溶液润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1mol/L的HA溶液中 ![]() =1010 , 0.01mol/L的BOH溶液pH=12.请回答下列问题:
=1010 , 0.01mol/L的BOH溶液pH=12.请回答下列问题:
(1)HA是________(填“强电解质”或“弱电解质”,下同),BOH是________。
(2)HA的电离方程式是________。其中由水电离出的c(H+)=________mol/L。
(3)在加水稀释HA的过程中,随着水量的增加而减小的是_______(填字母)。
A.![]() B.
B.![]() C.c(H+)与c(OH﹣)的乘积D.c(OH﹣)
C.c(H+)与c(OH﹣)的乘积D.c(OH﹣)
(4)将等体积等物质的量浓度的HA溶液和BOH溶液混合后的溶液呈________性,请用离子方程式解释其原因_______________________,混合溶液中各离子浓度由大到小的顺序是_______________________。
(5)常温下pH=12的BOH溶液100mL,加0.01mol/L NaHSO4使溶液的pH为11。(混合溶液体积变化忽略不计),应加 NaHSO4________mL。(保留到小数点后一位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com