
����Ŀ���밴Ҫ����գ�
(1)д��![]() �еĹ����ŵ�����_____��
�еĹ����ŵ�����_____��
(2)![]() ��������___________��
��������___________��
(3)CH2=CH��CH3�ڴ����������������ɾۺ���ķ�Ӧ����ʽΪ__________ ��
(4)д��ʵ��������ϩ�Ļ�ѧ��Ӧ����ʽ____________��
(5)�ٳ�ȡ34gij�л�������A����ȫȼ�պ�����18gH2O��88gCO2����֪���л��������������������ܶ�Ϊ68������л���ķ���ʽΪ_____________��
�ڸ��л���A�ĺ˴Ź������ͺ���������£�
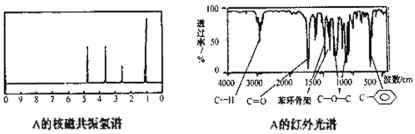
���Ʋ��л���A�Ľṹ��ʽΪ___________________��
���𰸡�̼̼˫����ȩ�� �������� nCH3CH=CH2![]()
 CH3CH2OH
CH3CH2OH ![]() CH2=CH2�� +H2O C8H8O2
CH2=CH2�� +H2O C8H8O2 ![]()
��������
(1)���л���Ľṹ��֪�����к������ֹ����ţ��ֱ�Ϊ̼̼˫����ȩ����
(2)���л���Ľṹ��֪�����л����������࣬�������ɼ�����Ҵ������õ�������������������
(3)��ϩ���Է����Ӿ۷�Ӧ���ɾ۱�ϩ���� ��
��
(4)ʵ��������ϩ���������Ҵ�������ȥ��Ӧ��ȡ��ע������ΪŨ�����170�棻
(5)����ͬ�����£������ܶ�֮�ȼ�ΪĦ������֮�ȣ���˿ɸ������������������л����Ħ������Ϊ136g/mol��34g���л��T0.25mol���ٸ�������ȫȼ�յIJ�����ˮ��CO2����ȷ���л������ʽ��C��H�ĸ����������������غ㣬ȷ���л������Ƿ�����Ԫ�أ��Լ�����ʽ��O�ĸ��������տ�ȷ���л���ķ���ʽΪC8H8O2��
�����л���ĺ˴Ź���������ͼ��֪���л����к���4�ֵ�Ч��ԭ�ӣ������������ֵ�Ч��ԭ�Ӹ�����ͬ������л���ķ���ʽ�����䲻���Ͷ�Ϊ5����Ϻ��������ͼ��֪���л����к��еı�����̼��˫���Ľṹ���ô�����5�������Ͷȣ��ٸ��ݺ�����ͼ�е��������շ����Ϣ�Լ��˴Ź���������Ϣ��������ȷ���л���Ľṹ��
(1)���л���Ľṹ��֪���л����й����ŵ�����Ϊ̼̼˫����ȩ����
(2)���л���Ľṹ��֪���л��������Ϊ����������
(3)�ɱ�ϩ���ɾ۱�ϩ�ķ���ʽΪ��nCH3CH=CH2![]()
 ��
��
(4)���Ҵ���ȥ��ȡ��ϩ�ķ���ʽΪ��CH3CH2OH![]() CH2=CH2�� +H2O��
CH2=CH2�� +H2O��
(5)�������֪�����л����Ħ������Ϊ136g/mol����ô34g��0.25mol��0.25mol�ĸ��л�����ȫȼ�պ�������1molH2O��2molCO2�������л�������к���8��C��8��H������1molH2O��2molCO2��H��C��������Ϊ26g�����34g���л����л�����8g����Ԫ�أ���0.5mol����ô�л������ʽ��O�ĸ���Ϊ2�����������л���ķ���ʽΪC8H8O2��
�����л���ķ���ʽ�����䲻���Ͷ�Ϊ5����Ϻ��������ͼ��֪����Ӧ�������л����еı�����̼��˫���Ľṹ�����⣬���������ʾ�л����л�����C-O-C�Լ�![]() �Ľṹ�����ǵ��л�������н���8��̼ԭ�ӣ������л����д���
�Ľṹ�����ǵ��л�������н���8��̼ԭ�ӣ������л����д���![]() �Ľṹ���ٸ��ݺ�����ͼ��Ϣ��֪���л����л�����1��̼��˫����Ϊ�˱�֤�л����н�����4�ֵ�Ч��ԭ�ӣ�̼��˫����λ��ֻ�����뱽��ֱ��������̼ԭ���ϣ������������л���ĽṹΪ
�Ľṹ���ٸ��ݺ�����ͼ��Ϣ��֪���л����л�����1��̼��˫����Ϊ�˱�֤�л����н�����4�ֵ�Ч��ԭ�ӣ�̼��˫����λ��ֻ�����뱽��ֱ��������̼ԭ���ϣ������������л���ĽṹΪ![]() ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������µ��ܱ������У�4NH3(g)��5O2(g)![]() 4NO(g)��6H2O(g) ��H����905.9kJ��mol��1������������ȷ���ǣ� ��
4NO(g)��6H2O(g) ��H����905.9kJ��mol��1������������ȷ���ǣ� ��
A.4molNH3��5molO2��Ӧ���ﵽƽ��ʱ�ų�����Ϊ905.9kJ
B.ƽ��ʱv��(O2)��![]() v��(NO)
v��(NO)
C.ƽ���ѹǿ���������ƽ��Ħ����������
D.ƽ��������¶ȣ����������NO��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС�������һ��ʵ����֤Ԫ�������ɡ�
(1)��ͬѧ��a��b��c��ֻ�ձ���ֱ����50 mLˮ���ٷֱ�μӼ��η�̪��Һ�����μ����С�����ﮡ��ơ��ؿ飬�۲�����ͬѧ��Ƹ�ʵ���Ŀ����_________________����Ӧ����ҵ��ձ���________(����ĸ)��������__________��ԭ��(�ӱ����Ͻ���)______________��
(2)��ͬѧ����֤ͬ����Ԫ�ؽ�����ǿ���Ĺ��ɣ����ѡ�õ�________���ڵ�________����Ԫ��(��Ԫ������)�����ʵ���ǽ���С�������С������ֱ�Ͷ����ͬŨ�ȵ�ϡ�����У��۲������ͣ�___________________��д���ƺ�ˮ��Ӧ�����ӷ���ʽ__________________________
(3)��ͬѧ���ʵ����֤�ǽ���Ԫ�صķǽ�����Խǿ����Ӧ����ۺ���������Ծ�Խǿ�����������ͼ��װ������֤����̼����Ԫ�صķǽ�����ǿ������ͬѧ��Ƶ�ʵ���ֱ��֤�������������ǿ������֪A��ǿ�ᣬ�����¿���ͭ��Ӧ��B�ǿ�״���壻��Һ©���Ļ�����C�пɹ۲쵽�а�ɫ�������ɡ�
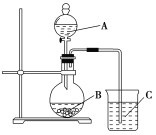
��д����ѡ�����ʵĻ�ѧʽ��A��________��B��________��C��________��
��д���ձ��з�����Ӧ�����ӷ���ʽ��_________________��
�۸�ʵ����ڵ�������___________________���Ľ���ʩΪ___________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾΪ800 ��ʱA��B��C�����������ܱ������з�ӦʱŨ�ȵı仯��ֻ��ͼ�Ϸ������ܵó��Ľ�����(����)
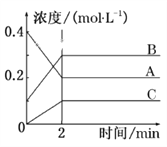
A. A�Ƿ�Ӧ��
B. ǰ2 min A�ķֽ�����Ϊ0.1 mol��L��1��min��1
C. ��ƽ����������¶ȣ�ƽ��������Ӧ�����ƶ�
D. ��Ӧ�ķ���ʽΪ2A(g)![]() 2B(g)��C(g)
2B(g)��C(g)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ����Ҫ����Դ�������Ʊ�һϵ�����ʣ�
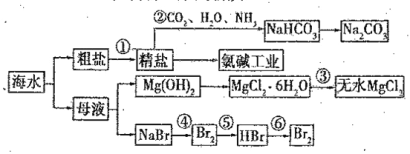
����˵����ȷ������ ��
A���������У�Ӧ��ͨCO2 ����ͨNH3
B���������ɽ�MgCl2��6H2O�����ڿ�����ֱ�Ӽ�����ˮ
C������������������Ӧ�У���Ԫ�ؾ�������
D����ȥ�����е� SO42-��Ca2+ ��Mg2+ �����ʣ������Լ�����ز���˳������ǣ�NaOH��Һ��BaCl2 ��Һ��Na2CO3 ��Һ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ĵ��뷽��ʽ��____________________________________________
��˵��������������ʵ���ʵ��_____________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������X��һ����Ҫ���л�����ԭ�ϣ���Է�������Ϊ92������Ϊ��ʼԭ�Ͽ��Ի������ͼ��ϵ���л�����![]() ���ֲ���ϳ�·�ߡ���Ӧ������ȥ
���ֲ���ϳ�·�ߡ���Ӧ������ȥ![]() ��H��һ�ֹ��ܸ߷��ӡ�
��H��һ�ֹ��ܸ߷��ӡ�
��֪�� I�� ![]()
![]()
![]()
II��![]()
![]()
![]()
![]() �������ױ�����
�������ױ�����![]()
�������ѧ֪ʶ�뱾��������Ϣ�ش����⣺
(1)F������Ϊ_______��A��ƽ���ԭ�������Ϊ_____����
(2)��Ӧ![]() �������� _______ ��
�������� _______ ��
(3)H���еĹ���������Ϊ _________ ��
(4)��Ӧ![]() �Ļ�ѧ����ʽ�� _________ ��
�Ļ�ѧ����ʽ�� _________ ��
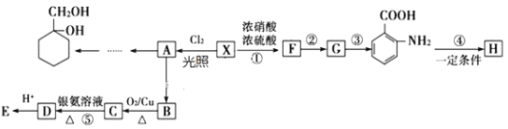
(5) �ж���ͬ���칹�壬�����ܷ���������Ӧ����ʹFeCl3��Һ����ɫ���л�����___�֡�
�ж���ͬ���칹�壬�����ܷ���������Ӧ����ʹFeCl3��Һ����ɫ���л�����___�֡�
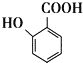
(6)д����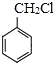 ��������������ϳ�
��������������ϳ�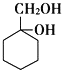 �ĺϳ���·_____________��
�ĺϳ���·_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����0.1000mol��L-1NaOH��Һ�ζ�20mL0.1000mol��L-1һԪ��HA(pKa=-lgKa=4.75)��Һ����ζ�������ͼ��ʾ������˵����ȷ����
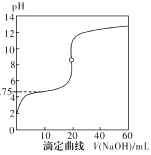
A.������40mLNaOH��Һʱ����Һ�У�c(Na+)>c(A-)>c(OH-)>c(H+)
B.����Һ��c(H+)+c(OH-)=2��10-7ʱ��c(Na+)>c(A-)>c(OH-)=c(H+)
C.������NaOH��Һ20mLʱc(OH-)>c(H+)+c(HA)
D.���ζ���pH=4.75ʱ��c(A-)=c(HA)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���з�Ӧ���Ȼ�ѧ����ʽ��
6C(s)+5H2(g)+3N2(g)+9O2(g)= 2C3H5(ONO2)3(l) ��H1��
H2(g)+ ![]() O2(g)=H2O(g) ��H2 �� C(s)+O2(g)=CO2(g) ��H3
O2(g)=H2O(g) ��H2 �� C(s)+O2(g)=CO2(g) ��H3
��Ӧ4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)����HΪ��������
A.12��H3+10��H2��2��H1B.2��H1��10��H2��12��H3
C.12��H3��10��H2��2��H1D.��H1��10��H2��12��H3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com