
【题目】高铁酸钾在饮用水源和废水处理过程中,不仅能去除污染物和致癌化学污染物,而且不产生任何诱变致癌的产物,具有高度的安全性;其可溶于水,微溶于浓 KOH 溶液,且在强碱性溶液中比 较稳定。实验室用次氯酸盐氧化法制备高铁酸钾(K2FeO4)的流程如图所示:
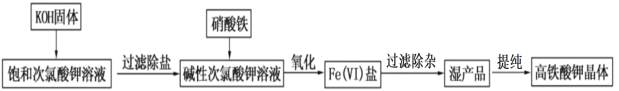
流程图中的饱和次氯酸钾溶液的制备装置如图所示:
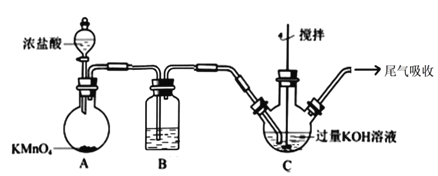
(1)A 为氯气发生装置。A 中反应的离子方程式是___________;装置 B 内的试剂及作用是____________;
(2)装置 C 反应温度控制在 0~5℃进行,在不改变 KOH 溶液浓度前提下,实验中可采取措施是________。
(3)流程图中在加入 KOH 固体的时候会产生大量的白色沉淀_____(填化学式)。
(4)在搅拌下,将 Fe(NO3)3饱和溶液缓慢滴加到 KClO 饱和溶液中即可制取 K2FeO4,写出该反应的离子方程式__________;反应过程中温度控制在 10~15℃,温度过低或过高对反应的影响是_____________。
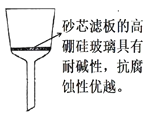
(5)过滤除杂时不用普通漏斗和滤纸而采用砂芯漏斗(如图)的原因是_____________。
(6)在提纯高铁酸钾时采用重结晶、洗涤、干燥的方法,洗涤剂可以选用_____。
A.H2O B.浓 KOH 溶液 C.Fe(NO3)3溶液 D.异丙醇
(7)若提纯得到 a gK2FeO4(M=198g/mol),上述流程中有 5%的 Fe 损失,则需要提供 Fe(NO3)3(M=242g/mol)的质量为_____g(用含 a 的计算式表示)。
【答案】2MnO4-+10Cl-+16H+=Mn2++5Cl2↑+8H2O 饱和食盐水、吸收杂质HCl气体 将C装置置于冰水浴中冷却 KCl 3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O 温度过低或过高对反应的影响是温度太低,反应速率慢影响产品的产率,温度太高,会含有杂质,氧化剂的有效浓度降低,从而使反应速率和转化率下降; 普通漏斗和滤纸在碱性条件下容易被腐蚀,而砂芯漏斗的滤板耐碱性和抗腐蚀性较好 BD ![]() g
g
【解析】
A装置制备氯气,B装置除去氯气中混有的HCl气体,C装置制备K2FeO4,尾气吸收装置吸收未反应的氯气,防止污染空气。
(1)A 为氯气发生装置,高锰酸钾与浓盐酸生成氯化锰和氯气。A 中反应的离子方程式是2MnO4-+10Cl-+16H+=Mn2++5Cl2↑+8H2O;生成的氯气中含有氯化氢,装置 B 内的试剂是饱和食盐水,作用是吸收HCl气体;故答案为:2MnO4-+10Cl-+16H+=Mn2++5Cl2↑+8H2O;饱和食盐水、吸收杂质HCl气体;
(2)C装置制备K2FeO4,反应温度控制在 0~5℃进行,在不改变 KOH 溶液浓度前提下,实验中可采取措施是将C装置置于冰水浴中冷却。故答案为:将C装置置于冰水浴中冷却;
(3)发生的反应方程式为2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2O,KCl溶解度小,饱和后易析出,流程图中在加入 KOH 固体的时候会产生大量的白色沉淀KCl。故答案为:KCl;
(4)在搅拌下,将 Fe(NO3)3饱和溶液缓慢滴加到 KClO 饱和溶液中即可制取 K2FeO4,在KOH溶液中,Fe(NO3)3与KClO应生成K2FeO4、KCl和KNO3,反应的方程式为:2 Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2O,该反应的离子方程式3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O;反应过程中温度控制在 10~15℃,温度过低或过高对反应的影响是温度太低,反应速率慢,影响产品的产率,温度太高,会含有杂质,氧化剂的有效浓度降低,从而使反应速率和转化率下降。故答案为:3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O;温度过低或过高对反应的影响是温度太低,反应速率慢,影响产品的产率,温度太高,会含有杂质,氧化剂的有效浓度降低,从而使反应速率和转化率下降;
(5)过滤除杂时不用普通漏斗和滤纸而采用砂芯漏斗的原因是普通漏斗和滤纸在碱性条件下容易被腐蚀,而砂芯漏斗的滤板耐碱性和抗腐蚀性较好。故答案为:普通漏斗和滤纸在碱性条件下容易被腐蚀,而砂芯漏斗的滤板耐碱性和抗腐蚀性较好;
(6)K2FeO4可溶于水、微溶于浓KOH溶液,在异丙醇中溶解度也比较小,在提纯高铁酸钾时采用重结晶、洗涤、干燥的方法,洗涤剂可以选用B.浓 KOH 溶液D.异丙醇;故答案为:BD。
(7)由铁原子守恒:Fe(NO3)3~K2FeO4
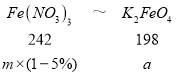
m=![]() g,故答案为:
g,故答案为:![]() g。
g。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】我们利用物质的结构与性质对周期表进行研究,有助于我们更好地掌握同类知识。
(1)基态砷原子中,价电子占用__个原子轨道;雌黄分子式为As2S3,分子结构如图,则砷原子的杂化方式为__。

(2)向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体;该晶体所含的非金属元素中,N、O、S第一电离能由大到小的顺序是__(填元素符号),SO42-的空间构型为__,晶体中含有的化学键有__。加入乙醇后析出[Cu(NH3)4]SO4·H2O晶体的原因是__。
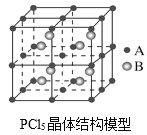
(3)常温下PCl5是一种白色晶体,其立方晶系晶体结构模型如图所示,由A、B两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知A微粒与CCl4具有相同的空间构型和相似的化学键特征,则A为__,B为__。
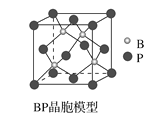
(4)磷化硼(BP)是一种超硬耐磨涂层材料,如图为其立方晶胞。已知晶体中最近的硼原子和磷原子核间距为xcm,磷化硼的摩尔质量为bg·mol-1,阿伏加德罗常数为NA,则磷化硼晶体密度的表达式为__g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,直到近年来人们才研究出来其成分为BaCuSi4O10,BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均具有Cun+离子,n=___,基态时该阳离子的价电子排布式为______。
(2)“中国蓝”的发色中心是以Cun+为中心离子的配位化合物,其中提供孤对电子的是___元素。
(3)合成“中国蓝”、“中国紫”的原料有BaCO3,孔雀石Cu2(OH)2CO3和砂子(SiO2)。SiO2晶体中Si原子的杂化轨道是由______轨道(填轨道的名称和数目)和________轨道杂化而成的。
(4)现代文物分析发现,“中国蓝”中含有微量硫元素。假若硫元素来源一种阴离子是正四面体的天然钡矿中,则最可能的钡矿化学式是______。
(5)在5500年前,古代埃及人就己经知道如何合成蓝色颜料—“埃及蓝”CaCuSi4O10,其合成原料中用CaCO3代替了BaCO3,其它和“中国蓝”一致。CO32一中键角∠OCO为___。根据所学,从原料分解的角度判断“埃及蓝”的合成温度比“中国蓝”更___(填“高”或“低”)。
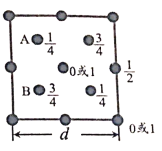
(6)自然界中的SiO2,硬度较大,主要原因是___。下图为SiO2晶胞中Si原子沿z轴方向在xy平面的投影图(即俯视投影图),其中O原子略去,Si原子旁标注的数字表示每个Si原子位于z轴的高度,则SiA与SiB的距离是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学变化中的能量转换对于生产具有重大意义和研究价值。回答下列问题:
(l)中科院大连化学物理研究所的科研人员在新型纳米催化剂Na-Fe3O4和HMCM-22的表面将CO2转化为烷烃,其过程如图。

①过程Ⅰ能量__(填“释放”或“吸收”。
②已知:CO2(g)+H2(g)═CO(g)+H2O(g) △H═+41kJmol-1:
2CO2(g)+6H2(g)═C2H4(g)+4H2O(g) △H═-128kJmol-1:
3CO2(g)+9H2(g)═C3H6(g)+6H2O(g) △H═+157.5kJmol-l
C2H4(g)+C3H6(g)+H2(g)═C5H12(异戊烷,g) △H=+267.6kJmol-1。
则5CO(g)+11H2(g)═C5H12(异戊烷,g)+5H2O(g)△H=__kJmol-1。
(2)一种铜版画雕刻用的酸性蚀刻液的有效成份是CuCl2,蚀刻反应为:Cu2++Cu+6Cl-═2CuCl32-。工业上用电解法将CuCl32-转化为Cu2+,使蚀刻液再生并回收金属Cu。装置如图(电极不参与反应)。

①再生的CuCl2蚀刻液为流出液__(填“a”或“b”)。
②写出N极的电极反应:__。
③装置中使用___离子交换膜(填“阳”或“阴”)。若电解池工作前,阴极室和阳极室中电解液质量相等,当转移0.1mol电子,流出液未流出时,两侧电解液的质量差为__g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学涉及多种常数。 下列说法正确的是
A.两种物质反应,不管怎样书写化学方程式,平衡常数不变
B.对于反应:3A(g)+2B(g) 4C(s)+2D(g)的化学平衡常数表达式为 K= ![]()
C.KW 不是水的电离平衡常数
D.难溶电解质 AB2 饱和溶液中,c(A2+)=x mol·L-1,c(B-)=y mol·L-1,则 Ksp 值为 4xy2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法,其流程如下图所示。已知向反应中得到的产物中加过量I2会得到两层溶液——含低浓度I2的H2SO4层和含高浓度I2的HI层,这两层分别进行反应Ⅱ和Ⅲ,循环分解制氢。下列说法错误的是( )
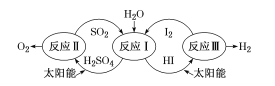
A.反应I的化学方程式为 SO2+2H2O+I2=H2SO4+2HI
B.该流程将太阳能转化为化学能,且降低了水分解制氢的活化能
C.H2SO4层和HI层在加I2之前和加I2之后均分成两层,且两层密度、颜色均不相同
D.SO2和I2是反应 2H2O =2H2+O2的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳捕集与封存是应对气候变化问题的解决方案之一。回答下列问题:
(l)我国科研团队利用低温等离子体协同催化技术,在常温常压下实现了将CO2和CH4一步转化为化工产品。试写出 CO2与CH4合成乙酸的热化学方程式:____。
(甲烷和乙酸的燃烧热分别为-890.31 kJ/mol、-876.72 kJ/mol)
(2)在某一钢性密闭容器中CH4、CO2的分压分别为15 kPa、20 kPa,加入Ni/α-Al2 O3催化剂并加热至1123 K使其发生反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
①研究表明CO的生成速率v(CO)=1.28![]() 10-2﹒p(CH4)
10-2﹒p(CH4)![]() p(CO2)(kPa
p(CO2)(kPa![]() s-1),某时刻测得p(H2)=10 kPa,则 p(CH4)=___kPa,v(CO)=___kPa
s-1),某时刻测得p(H2)=10 kPa,则 p(CH4)=___kPa,v(CO)=___kPa![]() s-1。
s-1。
②达到平衡后测得体系压强是起始时的![]() ,则该反应的平衡常数Kp=____kPa)2。
,则该反应的平衡常数Kp=____kPa)2。
(3)氮化镓(GaN)与Cu可组成如图所示的人工光合系统,该装置能以CO2和H2O为原料合成CH4。
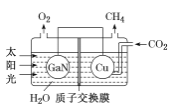
①该装置工作时H+移向____(填“GaN”或“Cu”)电极,该电极上的电极反应式为 ___。
②该装置每产生1 mol CH4,左极室溶液质量减少____g。
③本实验条件下,若CO2转化为烃(如甲烷、乙烯等)的转化率为10%,生成CH4的选择性为12%,现收集到12 mol CH4,则通入的CO2为____mol。(已知:选择性=生成目标产物消耗的原料量/原料总的转化量)
(4)上述人工光合系统装置也可以制备乙烯、乙炔等重要化工原料。2010年Sheth等研究得出乙炔在Pd表面选择加氢的反应机理,如下图所示。其中吸附在Pd表面的物质用“*”标注。
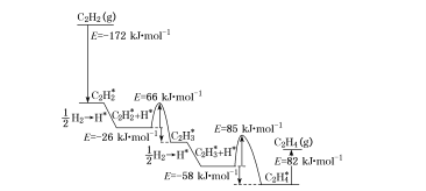
上述吸附反应为 ____填“吸热”或“放热”)反应,该过程中最小能垒(活化能)为___ kJ![]() mol-1,该步骤的化学方程式为____。
mol-1,该步骤的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是( )

A. a和b都属于芳香族化合物
B. a和c分子中所有碳原子均处于同一平面上
C. a、b和c均能使酸性KMnO4溶液褪色
D. b和c均能与新制的Cu(OH)2反应生成红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是()
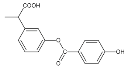
①分子式为C16H14O5 ②能使酸性高锰酸钾溶液褪色 ③能发生加成反应,但不能发生取代反应 ④苯环上的一溴代物有6种 ⑤1mol 该有机物与NaOH反应时最多消耗4mol NaOH ⑥1mol该有机物在一定条件下和H2反应,共消耗6molH2
A.①②③⑥B.①②③⑤C.①③④⑤⑥D.①②④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com