
| A. | [Cl-]>[NH4+]>[H+]>[OH-] | B. | [Cl-]>[H+]>[NH4+]>[OH-] | C. | [NH4+]>[OH-]>[Cl-]>[H+] | D. | [OH-]>[H+]>[Cl-]>[NH4+] |
分析 A.若为NH4Cl溶液,NH4+离子水解溶液呈酸性,水解程度很小,则符合;
B.若为NH4Cl、HCl混合溶液,HCl浓度远大于NH4Cl浓度,则符合;
C.若为氨水和盐酸的混合液,且氨水浓度过量,可以满足该离子浓度关系;
D.任何电中性溶液,都必须遵循电荷守恒,根据电荷守恒判断.
解答 解:A、若为NH4Cl溶液,NH4+离子水解溶液呈酸性,水解程度很小,溶液中离子浓度大小为:[Cl-]>[NH4+]>[H+]>[OH-],故A正确;
B.若为NH4Cl、HCl混合溶液,HCl浓度远大于NH4Cl浓度,溶液中离子浓度大小为:[Cl-]>[H+]>[NH4+]>[OH-],故B正确;
C.若为氨水和盐酸的混合液,且氨水浓度较大时,溶液中可以满足:[NH4+]>[OH-]>[Cl-]>[H+],故C正确;
任何电中性溶液,都必须遵循电荷守恒,即:c(Cl-)+c(OH-)=c(H+)+c(NH4+),显然在两对阴、阳离子浓度比较中,结果不可能相同,即不可能有:c(Cl-)>c(NH4+)、c(OH-)>c(H+),故C错误;
D.任何电中性溶液,都必须遵循电荷守恒,离子浓度[OH-]>[H+]>[Cl-]>[NH4+]违反了电荷守恒,故D错误;
故选D.
点评 本题考查离子浓度大小比较,难度中等,离子浓度大小比较,通常考虑电解质电离、盐类水解、水的电离、电荷守恒、物料守恒、质子恒等式等,注意水解程度很小,弱电解质电离程度不大.


科目:高中化学 来源: 题型:解答题
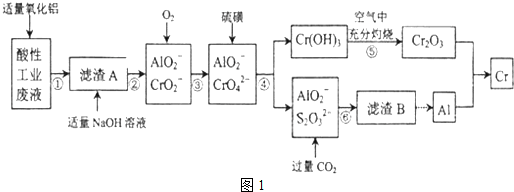
| 化合物 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| 完全沉淀的PH | 10.5 | 4.3 | 5.3 |
| 开始溶解的pH | -- | 7.8 | 9.2 |
| Ksp近似值 | 10-12 | 10-14 | 10-31 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH相同的①CH3COONa、②NaHCO3、③C6H5ONa,三份溶液中的c(Na+):③>②>① | |
| B. | 0.1mol•L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)═2c(A2-)+c(HA-)+c(H2A) | |
| C. | 在电解食盐水的实验中,若电解后溶液总体积为1L,阴极析出的气体的分子数为0.5NA,电解后溶液的pH为12 | |
| D. | 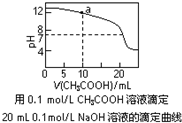 如图中a点溶液中各离子浓度的关系是:c(OH-)═c(H+)+c(CH3COO-)+2c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-) | B. | c(HAc)>c(CH3COO-) | ||
| C. | 2c(H+)=c(CH3COO-)-c(CH3COOH) | D. | c(CH3COOH)+c(CH3COO-)=0.02mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
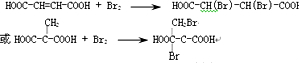
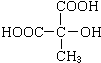 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
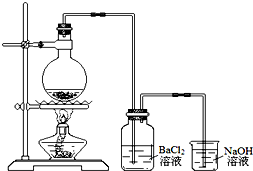 某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按如图所示装置进行实验.
某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按如图所示装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C生成的速率与C分解的速率不相等 | |
| B. | A、B、C的浓度不再变化 | |
| C. | 单位时间生成nmolA,同时生成3nmolB | |
| D. | A、B、C的分子数之比为1:3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com