
 过碳酸钠(2Na2CO3•3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,易分解.可用纯碱与H2O2反应制取,反应方程式为:2Na2CO3(aq)+3H2O2(aq)?2Na2CO3•3H2O2(s)△H<0,如图是制取过碳酸钠 的示意图,步骤如下
过碳酸钠(2Na2CO3•3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,易分解.可用纯碱与H2O2反应制取,反应方程式为:2Na2CO3(aq)+3H2O2(aq)?2Na2CO3•3H2O2(s)△H<0,如图是制取过碳酸钠 的示意图,步骤如下分析 (1)过滤时用到的玻璃仪器有:烧杯、玻璃棒、漏斗;
(2)钠离子浓度增大,降低过碳酸钠的溶解度;
(3)温度过高,导致过碳酸钠分解;
(4)过碳酸钠相当于带结晶双氧水的碳酸钠,具有甲酸钠、双氧水的性质,在水中溶解度较大,碳酸钠能与稀盐酸、硫酸锰反应,锰离子会催化过氧化氢的分解;
(5)加入最后一滴高锰酸钾溶液,溶液颜色由无色变为紫色,且半分钟内不褪色,说明滴定到达终点;根据方程式计算样品中过碳酸钠的质量,进而计算样品中过碳酸钠质量分数.
解答 解:(1)过滤时用到的玻璃仪器有:烧杯、玻璃棒、漏斗,
故答案为:烧杯、玻璃棒、漏斗;
(2)加入氯化钠固体,钠离子浓度增大,降低了过碳酸钠的溶解度,
故答案为:增大钠离子浓度、降低产品的溶解度(盐析作用);
(3)制备过碳酸钠是放热反应,反应过程中放出的热量使温度升高,温度过高会导致过碳酸钠分解,从而降低其产率,应控制温度不能过高,
故答案为:温度过高会导致过碳酸钠分解,降低其产率,
(4)过碳酸钠相当于带结晶双氧水的碳酸钠,具有甲酸钠、双氧水的性质,在水中溶解度较大,用水洗涤,损失较大,碳酸钠能与稀盐酸、硫酸锰反应,锰离子会催化过氧化氢的分解,促进过碳酸钠反应而导致失效,过碳酸钠难溶于乙醇,用乙醇洗涤减少损失,乙醇易挥发,利用干燥,故选:d;
(5)加入最后一滴高锰酸钾溶液,溶液颜色由无色变为紫色,且半分钟内不褪色,说明滴定到达终点;
设样品中过碳酸钠的质量为m,消耗高锰酸钾的物质的量为:2.000×10-2 mol•L-1×0.015L=3.000×10-4mol,则:
6KMnO4+5(2Na2CO3•3H2O2)+19H2SO4=K2SO4+6MnSO4+10Na2SO4+10CO2↑+15O2↑+34H2O,
6mol 5×314g
3.000×10-4mol m
故=$\frac{5×314g×3×1{0}^{-4}mol}{6mol}$=0.0785g
故样品中过碳酸钠的质量分数为$\frac{0.0785g}{0.1g}$×100%=78.5%,
故答案为:加入最后一滴高锰酸钾溶液,溶液颜色由无色变为紫色,且半分钟内不褪色;78.5%.
点评 本题考查制备实验方案,涉及基本操作、对操作的分析评价、物质的分离提纯、氧化还原滴定测定含量等,侧重考查知识迁移运用,需要学生具备扎实的基础,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
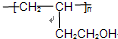 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应现象相同,反应类型相同 | B. | 反应现象相同,反应类型不同 | ||
| C. | 反应现象不同,反应类型相同 | D. | 反应现象不同,反应类型不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
| 平行实验次数 | 1 | 2 | 3 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点.回答下列问题:
以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点.回答下列问题: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com