
【题目】反应4A(g)+5B(g)═4C(g)+4D(g)在0.5L密闭容器中进行,30s后A减少了0.90mol,则此反应的速率可表示为( )
A.v(A)=0.030 mol/(Ls)
B.v(B)=0.075 mol/(Ls)
C.v(C)=0.030 mol/(Ls)
D.v(D)=0.030 mol/(Ls)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质,按化合物、单质、混合物顺序排列的是( )
A. Fe(OH)3胶体、白磷、石灰乳B. 干冰、铁、氯化氢
C. 烧碱、液态氧、碘酒D. 空气、氮气、明矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列化学方程式或离子方程式。
(1)实验室多余氯气的尾气处理:离子方程式_____________________________________________。
(2)过氧化钠与水反应:离子方程式___________________________________________________。
(3)一步反应实现CO2转化为C :化学方程式____________________________________________。
(4)溶液中新制氢氧化亚铁未隔绝空气,迅速变成灰绿色,最后变成红褐色:
化学方程式____________________________________________________________。
(5)试配平氧化还原反应方程式:______________
![]() Na2Cr2O7+
Na2Cr2O7+![]() SO2+
SO2+![]() H2O===
H2O===![]() Cr(OH)(H2O)5SO4+
Cr(OH)(H2O)5SO4+![]() Na2SO4;
Na2SO4;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁易被氧化而变质。为检验某补血剂中硫酸亚铁是否变质,可向该补血剂配成的溶液中加入
A.AgNO3溶液B.盐酸酸化的BaCl2溶液
C.KSCN溶液D.HNO3酸化的Ba(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol。在相同温度下,相同容积的恒容容器中,实验测得起始、平衡时的有关数据如下表:
2NH3(g) ΔH=-92.4 kJ/mol。在相同温度下,相同容积的恒容容器中,实验测得起始、平衡时的有关数据如下表:
实验 编号 | 起始时各物质的物质的量/mol | 达到平衡时体系的变化 | 平衡时NH3的体积分数 | ||
N2 | H2 | NH3 | |||
① | 1 | 3 | 0 | 放出热量:23.1 kJ | W1 |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q kJ | W2 |
则下列关系中正确的是
A. W1=W2,Q<23.1 B. W1=W2,Q=23.1
C. W1<W2,Q>23.1 D. W1>W2,Q<23.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)反应I溶液中存在的金属阳离子有___________________________。
(2)加入少量NaHCO3的目的是调节pH,使溶液中的________(填“Fe3+”、“Fe2+”或“Al3+”)沉淀。该工艺流程中“搅拌”的作用是______________________。
(3)反应Ⅱ的离子方程式为 ____________________________。在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作______________。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42-聚合离子。该水解反应的离子方程式为____________________________。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填字母)。
A. 氯水 B. KSCN溶液 C. NaOH溶液 D. 酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学基本概念的判断正确的是( )
A.含有极性键的分子一定是极性分子B.含有共价键的化合物一定是共价化合物
C.含有离子键的化合物一定是离子化合物D.组成上相差n个CH2的分子一定是同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。工业用如下流程,从酸性废液(主要含Cu2+、Fe3+、 H+、Cl-)中制备氯化亚铜。
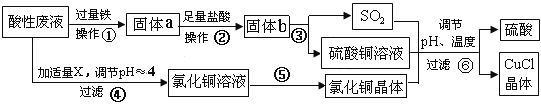
请回答下列问题:
(1)写出步骤①中发生的两个主要反应的离子方程式:_________________________。
(2)步骤②的操作名称是:_____________。
(3)步骤④中所加物质X为:__________。
(4)步骤⑤的操作是:___________________________________________________。
(5)步骤⑥应调节溶液pH呈酸性,且用乙醇洗涤CuCl晶体,目的是:______________。
(6)在CuCl的生成过程中,可以循环利用的物质是______________,理论上_____(填“是”或“否”)需要补充(不考虑调节等消耗);理由是__________________________________。
(7)工业上还可以采用以碳棒为电极电解CuCl2溶液得到CuCl。写出电解CuCl2溶液中的阴极上发生的电极反应 ___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,浓度都是1mol·L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z,反应2 min后,测得参加反应的X2为0.6 mol·L-1,用Y2浓度变化表示的化学反应速率v(Y2)=0.1 mol·(L·min)-1,生成的c(Z)为0.4 mol·L-1,则该反应的反应式可以表示为( )
A. X2+2Y2![]() 2XY2 B. 2X2+Y2
2XY2 B. 2X2+Y2![]() 2X2Y
2X2Y
C. 3X2+Y2![]() 2X3Y D. X2+3Y2
2X3Y D. X2+3Y2![]() 2XY3
2XY3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com