
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。工业用如下流程,从酸性废液(主要含Cu2+、Fe3+、 H+、Cl-)中制备氯化亚铜。
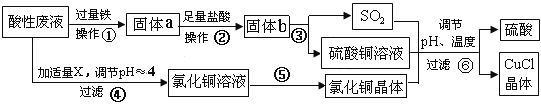
请回答下列问题:
(1)写出步骤①中发生的两个主要反应的离子方程式:_________________________。
(2)步骤②的操作名称是:_____________。
(3)步骤④中所加物质X为:__________。
(4)步骤⑤的操作是:___________________________________________________。
(5)步骤⑥应调节溶液pH呈酸性,且用乙醇洗涤CuCl晶体,目的是:______________。
(6)在CuCl的生成过程中,可以循环利用的物质是______________,理论上_____(填“是”或“否”)需要补充(不考虑调节等消耗);理由是__________________________________。
(7)工业上还可以采用以碳棒为电极电解CuCl2溶液得到CuCl。写出电解CuCl2溶液中的阴极上发生的电极反应 ___________________________________________。
【答案】 Cu2++ Fe = Cu+ Fe2+ Fe + 2Fe3+= 3Fe2+或Fe + 2H+= Fe2++ H2↑ 过滤、洗涤 CuO或Cu (OH)2或CuCO3等 在HCl足量的情况下蒸发结晶 减少CuCl的损失 硫酸(或H2SO4) 否 Cu与浓硫酸反应生成CuSO4和SO2的物质的量为1∶1,而生产CuCl的过程中消耗CuSO4和SO2的物质的量也为1﹕1,所以理论上不需要补充H2SO4 Cu2++Cl-+e-= CuCl
【解析】试题分析:从某酸性废液(主要含Cu2+、Fe3+、H+、Cl-)中制备氯化亚铜,向工业上以某酸性废液(含Cu2+、Fe3+、H+、Cl-)加入过量的铁粉,三价铁离子与铁粉反应转化为二价铁离子,铜离子与铁反应生成铜,然后过滤,滤渣为过量的铁和生成的铜,依据铜与铁活泼性,将滤渣溶于盐酸,铜与盐酸不反应,过滤得到滤渣即为铜,然后铜与浓硫酸反应生成硫酸铜和二氧化硫,酸性废液调节pH值使铁离子沉淀,过滤得氯化铜溶液,氯化铜、硫酸铜、二氧化硫反应生成氯化亚铜和硫酸,硫酸可以再循环利用,
(1)步骤①中铁能与铜离子及铁离子反应生成铜和亚铁离子等,同时铁也与酸性废液中的酸反应生成氢气,涉及的离子方程式为Cu2++Fe=Cu+Fe2+、Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑,故答案为:Cu2++Fe=Cu+Fe2+、Fe+2Fe3+=3Fe2+或Fe+2H+=Fe2++H2↑;
(2)步骤②中从溶液中分离出固体物质过量的铁和生成的铜,所以步骤②的操作名称是过滤、洗涤,故答案为:过滤、洗涤;
(3)步骤④中为调节溶液的pH值,要能与酸反应同时不引入新的杂质,所以物质X为CuO或Cu (OH)2或CuCO3等,故答案为:CuO或Cu (OH)2或CuCO3等;
(4)步骤⑤的操作是从氯化铜溶液中获得氯化铜晶体,要防止铜离子水解,所以步骤⑤的操作是在HCl气流中蒸发结晶,故答案为:在HCl气流中蒸发结晶;
(5)CuCl微溶于水、不溶于乙醇及稀硫酸,所以要用乙醇洗涤CuCl晶体,减少CuCl的损失,故答案为:减少CuCl的损失;
(6)根据流程分析可知,硫酸可以循环利用,Cu与浓硫酸反应生成CuSO4和 SO2的物质的量为1:1,而生产CuCl的过程中消耗CuSO4和SO2的物质的量也为1﹕1,所以理论上不需要补充H2SO4,故答案为:硫酸;否;Cu与浓硫酸反应生成CuSO4和 SO2的物质的量为1:1,而生产CuCl的过程中消耗CuSO4和SO2的物质的量也为1﹕1,所以理论上不需要补充H2SO4;(7)电解CuCl2溶液,阴极上是铜离子得电子生成亚铜离子,亚铜离子结合氯离子生成氯化亚铜沉淀,电极反应式为 Cu2++Cl-+e-=CuCl↓,
故答案为:Cu2++Cl-+e-=CuCl↓.


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
【题目】反应4A(g)+5B(g)═4C(g)+4D(g)在0.5L密闭容器中进行,30s后A减少了0.90mol,则此反应的速率可表示为( )
A.v(A)=0.030 mol/(Ls)
B.v(B)=0.075 mol/(Ls)
C.v(C)=0.030 mol/(Ls)
D.v(D)=0.030 mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定气体的体积的主要因素有( )
①气体的分子个数 ②气体分子的大小 ③气体分子间的平均距离 ④气体分子的相对分子质量
A. ①② B. ①③ C. ②③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是 ( )
A. 淀粉是糖类物质,有甜味
B. 可用植物油萃取溴水中的溴单质
C. 乙酸可被酸性KMnO4溶液氧化
D. 在加热条件下,可用银氨溶液鉴别葡萄糖和蔗糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向一容积为5 L的恒容密闭容器中充入0.4 mol SO2和0.2 mol O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196 kJ/mol。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) ΔH=-196 kJ/mol。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
(1 )判断该反应达到平衡状态的标志是___________(填字母)。
A.SO2、O2、SO3三者的浓度之比为2∶1∶2 B.容器内气体的压强不变
C.容器内混合气体的密度保持不变 D.SO3的物质的量不再变化
E.SO2的生成速率和SO3的生成速率相等
(2)①SO2的转化率=_______________;②达到平衡时反应放出的热量为____________kJ;③此温度下该反应的平衡常数K=__________。
(3)右图表示平衡时SO2的体积分数随压强和温度变化的曲线,则:

①温度关系:T1________T2(填“>”、“<”或“=”,下同);
②平衡常数关系:KA_________KB,KA_________KD。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以烃A和芳香烃D为原料合成化合物X的路线如图所示:

回答下列问题:
(1)A中含有官能团的名称是_______,F的名称是__________。
(2)E生成F的反应类型是___________。
(3)反应C+F→G的化学方程式为_______________________________。
(4)反应F→H的化学方程式为_________________________________。
(5)X的结构简式为________________,下列有关X的说法不正确的是________(填字母)
a.能发生水解反应 b.能发生银镜反应
c.不能使溴的四氯化碳溶液褪色 d.能与浓硝酸发生取代反应
⑹芳香族化合物M是G的同分异构体,M能与NaHCO3溶液反应产生气体,符合条
件的M有_____种,其中核磁共振氢谱有4组峰且峰面积之比为6:2:1:1的是______或______(填结构简式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com