
【题目】下列有关说法中正确的是 ( )
A. 淀粉是糖类物质,有甜味
B. 可用植物油萃取溴水中的溴单质
C. 乙酸可被酸性KMnO4溶液氧化
D. 在加热条件下,可用银氨溶液鉴别葡萄糖和蔗糖
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】在常温常压时,充分燃烧一定量的丁烷(C4H10)气体,放出热量Q kJ(Q>0),将生成的二氧化碳全部通入足量NaOH溶液中,发生的反应为:CO2+2NaOH=Na2CO3+H2O,共消耗了4molL﹣1的NaOH溶液200mL.则此条件下,下列热化学方程式正确的是( )
A.C4H10(g)+ ![]() O2(g)═4CO2(g)+5H2O(l)△H=﹣Q kJ?mol﹣1
O2(g)═4CO2(g)+5H2O(l)△H=﹣Q kJ?mol﹣1
B.C4H10(g)+ ![]() O2(g)═4CO2(g)+5H2O(l)△H=﹣10Q kJ?mol﹣1
O2(g)═4CO2(g)+5H2O(l)△H=﹣10Q kJ?mol﹣1
C.C4H10(g)+ ![]() O2(g)═4CO2(g)+5H2O(l)△H=+10Q kJ?mol﹣1
O2(g)═4CO2(g)+5H2O(l)△H=+10Q kJ?mol﹣1
D.C4H10(g)+ ![]() O2(g)═4CO2(g)+5H2O(g)△H=﹣10Q kJ
O2(g)═4CO2(g)+5H2O(g)△H=﹣10Q kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)反应I溶液中存在的金属阳离子有___________________________。
(2)加入少量NaHCO3的目的是调节pH,使溶液中的________(填“Fe3+”、“Fe2+”或“Al3+”)沉淀。该工艺流程中“搅拌”的作用是______________________。
(3)反应Ⅱ的离子方程式为 ____________________________。在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作______________。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42-聚合离子。该水解反应的离子方程式为____________________________。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填字母)。
A. 氯水 B. KSCN溶液 C. NaOH溶液 D. 酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,元素A的一种原子无中子,元素B和C都有2个电子层,它们能生成无色无嗅的气体BC2 , 元素D有三个电子层,它和元素C属于同一主族,D和C生成有刺激性气味的气体DC2;元素E的阳离子E+的电子层结构与Ne的电子层结构相同,试回答:
(1)它们的元素名称是:ABCDE .
(2)A与B的化合物以键结合,写出BA4的电子式;
C和E的化合物以键结合,写出E2C的电子式;
(3)A、B、C、E的原子半径从大到小的顺序为(写元素符号);
(4)写出A和C的化合物(A2C)与C和E的化合物(E2C2)反应的化学方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。工业用如下流程,从酸性废液(主要含Cu2+、Fe3+、 H+、Cl-)中制备氯化亚铜。
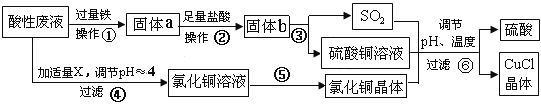
请回答下列问题:
(1)写出步骤①中发生的两个主要反应的离子方程式:_________________________。
(2)步骤②的操作名称是:_____________。
(3)步骤④中所加物质X为:__________。
(4)步骤⑤的操作是:___________________________________________________。
(5)步骤⑥应调节溶液pH呈酸性,且用乙醇洗涤CuCl晶体,目的是:______________。
(6)在CuCl的生成过程中,可以循环利用的物质是______________,理论上_____(填“是”或“否”)需要补充(不考虑调节等消耗);理由是__________________________________。
(7)工业上还可以采用以碳棒为电极电解CuCl2溶液得到CuCl。写出电解CuCl2溶液中的阴极上发生的电极反应 ___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将12mol/L的盐酸(ρ=1.19g/cm3)50mL稀释成6mol/L的盐酸(ρ=1.10g/cm3),需加水的体积约为( )
A. 50mL B. 50.5mL C. 55mL D. 59.5mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应mA(g)+nB(g) ![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )
pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )

A. 由图1可知,T1<T2,该反应正反应为吸热反应
B. 由图2可知,该反应m+n﹤p
C. 图3中,表示反应速率v正>v逆的是点3
D. 图4中,若m+n=p,则a曲线一定使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中所发生的化学变化属于取代反应的是( )
①光照射甲烷与氯气的混合气体
②乙烯通入溴水中
③在镍作催化剂的条件下,苯与氢气反应
④苯与液溴混合后撒入铁粉
A.①②B.①③C.②④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可以利用反应I:2CO(g)+SO2(g)![]() 2CO2(g)+S(l)△H1
2CO2(g)+S(l)△H1
所示原理降低污染气体的排放,并回收燃煤痼气中的硫。
(1)又已知:反应Ⅱ:2CO2(g)![]() 2CO(g)+O2(g)△H2=+566.0kJmol-1
2CO(g)+O2(g)△H2=+566.0kJmol-1
反应Ⅲ:S(l)+O2(g)![]() SO2(g)△H3=-296.0kJmol-1, 则△H1=______________。
SO2(g)△H3=-296.0kJmol-1, 则△H1=______________。
(2)T℃时,将0.100molCO(g)和0.120molSO2(g)充入2L恒容密闭容器中,发生反应I,各物质的物质的量随时间变化如下表所示。

①下列事实能说明该反应达到化学平衡状态的是________(填选项字母)。
A.容器内压强不再改变 B.每消耗2molCO2,同时生成2molCO
C.气体密度不再改变 D.v正(SO2)=2v逆(CO2)
②T℃时,将0.100molCO(g)和0.120molSO2(g)充入容积为2L的恒压密闭容器中,反应达到平衡时,CO2的体积分数与原平衡(恒容)相比将________。(填“增大”、“减小”或“不变”)。
(3)L(L1、L2),X可分别代表压强或温度。右图表示L一定时,反应Ⅱ中CO(g)的体积分数随X的变化关系。

①X代表的物理量为___________。
②判断L1、L2的大小关系,并简述理由:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com