
����Ŀ����ʵ�������ö������̸�Ũ���ᷴӦ�Ʊ����﴿�������������д�ʵ�飬����������ͼ��
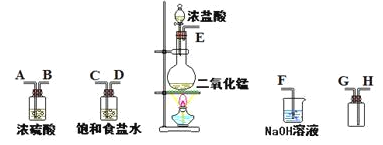
��1������������������ȷ˳���ǣ�����ӿڴ�����ĸ����E�� �� �� �� �� �� �� ��___
��2����װ���б���ʳ��ˮ���������___��
��3����ѧʵ���м����Ƿ���Cl2����������ֽΪ___��
��4��д������������Һ�з�Ӧ�����ӷ���ʽ___��
��5����0.2molMnO2��500mL12mol/L�����Ϻ����ȣ�MnO2��Ӧ��ȫ�������µ���Һ�м�������AgNO3��Һ������AgCl���������ʵ���Ϊ___������������Ļӷ����������ܽ⣩��
��6��ʵ����Ҳ������K2Cr2O7�����ᷴӦ��ȡCl2����ƽ��Ӧ����ʽ����ָ���������ͻ�ԭ�������ʵ���֮����___��________K2Cr2O7+________HCl=________KCl+________CrCl3+________Cl2��+________H2O
��7����֪��ԭ�ԣ�SO32->I-����amolKI��amolK2SO3�Ļ��Һ��ͨ��bmolCl2��ַ�Ӧ(������Cl2��I2֮��ķ�Ӧ)������˵������ȷ����___
A����a��bʱ�����������ӷ�ӦΪSO32-+Cl2+H2O=SO42-+2H++2Cl-
B����5a=4bʱ�����������ӷ�ӦΪ4SO32-+2I-+5Cl2+4H2O=4SO42-+I2+8H++10Cl-
C����a<b<![]() ʱ����Һ��SO42-��I-��Cl-�����ʵ���֮��Ϊa��(3a-2b)��2b
ʱ����Һ��SO42-��I-��Cl-�����ʵ���֮��Ϊa��(3a-2b)��2b
D����a��b��![]() ʱ����Ӧ��ת�Ƶ��ӵ����ʵ���n(e-)Ϊamol��n(e-)��3amol
ʱ����Ӧ��ת�Ƶ��ӵ����ʵ���n(e-)Ϊamol��n(e-)��3amol
���𰸡�CDABHGF ��ȥ�����е��Ȼ������� ʪ��ĵ�����KI��ֽ Cl2+2OH-=Cl-+ClO-+H2O 5.6mol 1��6 1 14 2 2 3 7 D
��������
��1������ʵ�����Ʊ�����װ�õ�һ������˳����װ��������װ�����ռ�װ����β������װ�ý��
��2�������������Ȼ�������ʷ�����
��3�����������������Է�����
��4������������Һ��������Ӧ�����Ȼ��ơ��������ƺ�ˮ��
��5�����ݷ�ӦMnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O���������������������ټ��㷴Ӧ��ȫ��������ӣ��ټ�������AgCl�������ʵ�����
MnCl2+Cl2��+2H2O���������������������ټ��㷴Ӧ��ȫ��������ӣ��ټ�������AgCl�������ʵ�����
(6)��Ӧ��K2Cr2O7��CrCl3, CrԪ�ػ��ϼ���+6����Ϊ+3��������6�ۣ�Cl-(Ũ)��Cl2, ClԪ�ػ��ϼ���-1������Ϊ0�۹�����Ϊ2�ۣ��ٸ���ԭ���غ���ƽ�������ʵ�ϵ������ƽ��ķ���ʽ��
(7)��ȷ������ԭ��Ӧ�еķ�Ӧ�Ⱥ�˳��������йص����ӷ���ʽ����д��ʽ�ǽ���ؼ�����ȷ������ԭ��Ӧ�еķ�Ӧ�Ⱥ�˳��������йص����ӷ���ʽ����д��ʽ�ǽ���ؼ�����ԭ�ԣ�SO32-��I-������amolKI��amolK2SO3�Ļ��Һ��ͨ��bmolCl2��ַ�Ӧ���������Ⱥ�SO32-��Ӧ����SO32-��Ӧ��ȫ�������ٺ�I-��Ӧ����amolK2SO3��ȫ��Ӧʱ������amol������amolKI��ȫ��Ӧʱ������a/2mol����������amolKI��amolK2SO3��ȫ��Ӧʱ��������1.5amol������
��1��ʵ��װ�õ�����˳��Ϊ������װ��������װ�����ռ�װ����β������װ�ã���Ϊ�ռ��������壬���Գ���װ���г����ܽ������̵��ܳ�������Ϊ����ʳ��ˮ����ˮ��Ũ��������ˮ�ԣ����������ӱ���ʳ��ˮװ�ú�����Ũ����װ�ã��ռ�װ���У���Ϊ������Ũ�ȴ��ڿ����ģ����Գ����ܽ����̵��ܳ�����
�ʴ�Ϊ��E��C��D��A��B��H��G��F��
��2�������л����Ȼ������ʣ��Ȼ��������ڱ���ʳ��ˮ�У������������ܣ������ñ���ʳ��ˮ��ȥ�����е��Ȼ������壻
��3����ѧʵ���м����Ƿ���Cl2����������ֽΪʪ��ĵ�����KI��ֽ������ֽ������������Ļ���ɫ����ΪCl2��
��4��β������ʱ����������Һ��������Ӧ�����Ȼ��ơ��������ƺ�ˮ����Ӧ�����ӷ���ʽΪCl2+2OH-=Cl-+ClO-+H2O��
��5����Ӧ�Ļ�ѧ����ʽΪMnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O��n��MnO2��=0.2mol��n��HCl��=0.5L��12mol/L=6mol�����ݷ���ʽ��֪0.2molMnO2��Ӧ��ҪHClΪ0.2mol��4=0.8mol<6mol����MnO2�ɷ�Ӧ��ȫ����MnO2��ȫ��Ӧ������������Ϊ0.2mol��2=0.4mol����Һʣ��Cl-Ϊ6mol-0.2mol��2=5.6mol�����ԣ���Ӧ��ȫ�������µ���Һ�м�������AgNO3��Һ������AgCl�������ʵ�������5.6mol��
MnCl2+Cl2��+2H2O��n��MnO2��=0.2mol��n��HCl��=0.5L��12mol/L=6mol�����ݷ���ʽ��֪0.2molMnO2��Ӧ��ҪHClΪ0.2mol��4=0.8mol<6mol����MnO2�ɷ�Ӧ��ȫ����MnO2��ȫ��Ӧ������������Ϊ0.2mol��2=0.4mol����Һʣ��Cl-Ϊ6mol-0.2mol��2=5.6mol�����ԣ���Ӧ��ȫ�������µ���Һ�м�������AgNO3��Һ������AgCl�������ʵ�������5.6mol��
(6)��Ӧ��K2Cr2O7��CrCl3, CrԪ�ػ��ϼ���+6����Ϊ+3��������6�ۣ�Cl-(Ũ)��Cl2, ClԪ�ػ��ϼ���-1������Ϊ0�۹�����Ϊ2�ۣ����ϼ�������С������Ϊ6����K2Cr2O7��ϵ��Ϊ1��Cl2 ��ϵ��Ϊ3���ٸ���ԭ���غ���ƽ�������ʵ�ϵ������ƽ��ķ���ʽΪK2Cr2O7+ 14HCl(Ũ) ![]() 2KCl+ 2CrCl3 +3Cl2��+7H2O��������K2Cr2O7�ͻ�ԭ��HCl�����ʵ���֮����1��6��
2KCl+ 2CrCl3 +3Cl2��+7H2O��������K2Cr2O7�ͻ�ԭ��HCl�����ʵ���֮����1��6��
(7) A����a��bʱ������ǡ���ܰ�SO32������Ϊ���������������ԭΪ�����ӣ������ӷ���ʽΪSO32-+Cl2+H2O=SO42-+2H++2Cl-��ѡ��A��ȷ��
B����5a=4b��a=0.8bʱ��0.8bmolSO32������0.8bmol������������Ϊ0.8bmolSO42-��0.2bmol����������0.4bmolI-ΪI2�������ӷ���ʽΪ��4SO32����2I����5Cl2��4H2O��4SO42����I2��8H����10Cl����ѡ��B��ȷ��
C����a��b��1.5aʱ��SO32-ȫ��������Ϊ���������I-����ȫ��������������Һ������������ʵ���Ϊamol�����ĵ�����Ϊamol����ʣ�������Ϊ��b-a��mol�����������ĵ����ӵ����ʵ���Ϊ2��b-a��mol������Һ�еĵ����ӵ����ʵ���Ϊamol-2��b-a��mol=��3a-b��mol������������ȫ��Ӧ������Һ�е������ӵ����ʵ���Ϊ2bmol�������Һ��SO42����I����Cl�������ʵ���֮��Ϊa����3a-2b����2b��ѡ��C��ȷ��
D����a��b��1.5aʱ����Ӧ��ת�Ƶ��ӵ����ʵ���n(e-)Ϊ 2amol��n(e-)��3amol��ѡ��D����ȷ��
��ѡD��


 �����Ծ���Ԫ���Ծ�ϵ�д�
�����Ծ���Ԫ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϸ�۲�����2��װ�ã�����˵����ȷ����
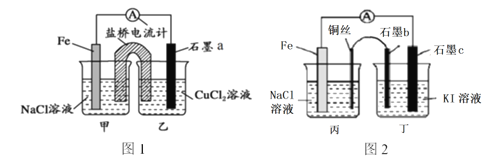
A. ͼ1ʯīaΪ������ͼ2ʯīcҲΪ����
B. ͼ1��ԭ���װ�ã����ŵ�������ʹ�������Һʼ�ձ��ֵ����ԣ����ṩ�����ȶ��ĵ�����ͼ2װ�ò����������
C. ͼ1ʯīa�缫�Ϸ����ķ�ӦΪ��O2��2H2O��4e��=4OH��
D. ͼ2ʯīb�ϵIJ�����ʹ������Һ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��������һ�ַdz����õĽ�����ͨ������________�С�����Ͷ������ͭ��Һ�У�������Ӧ�����ӷ���ʽΪ__________��_______��
(2)��һ����Һ�����ܺ���![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() �������е�һ�ֻ��֡��ּ���
�������е�һ�ֻ��֡��ּ���![]() ��ĩ����ɫ��ζ������ų���ͬʱ������ɫ������������Һ�е�ˮ����������
��ĩ����ɫ��ζ������ų���ͬʱ������ɫ������������Һ�е�ˮ����������![]() ���������ɰ�ɫ��������֮��Ĺ�ϵ��ͼ����ʾ�����ƶϣ�
���������ɰ�ɫ��������֮��Ĺ�ϵ��ͼ����ʾ�����ƶϣ�
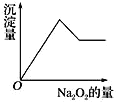
��ԭ��Һ��һ�����е�������_________________��
��һ�������е�������________________��
�ۿ��ܺ���__________��Ϊ�˽�һ��ȷ�����ܺ��и����ӣ���������ɫ��Ӧ��ʵ�飬����ɫ�ܲ����۲쵽�Ļ������ɫΪ______ɫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ̽��ij�������X(����4�ֶ�����Ԫ��)����ɺ����ʣ����й����ҿ��ƹ��ά������Ʋ��������ʵ�飺

��ش�
(1)X���˺���H��OԪ���������____________��
(2)���������;____________��
(3)X�Ļ�ѧʽ��____________��
(4)��������NaOH��Һ��Ӧ�����ӷ���ʽ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����и��������У���Ϊͬλ�ص���___(����ţ���ͬ)����Ϊͬϵ�����___����Ϊͬ���칹�����____��
�ٺ�������� ��![]() ��
��![]() ��CH3COOCH3��CH3CH2COOCH3 ��
��CH3COOCH3��CH3CH2COOCH3 �� ��
��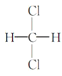 ��
��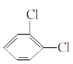 ��
��![]() ��
��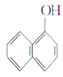 ��
��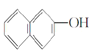 ���Ҵ��������
���Ҵ��������
��2����ϵͳ�������������л���������
��CH3CH(C2H5)CH(CH3)2��______��
��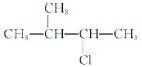 ��_____��
��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£������ƺ�CO2���Ƶý��ʯ��4Na+3CO2![]() 2Na2CO3+C(s�����ʯ)
2Na2CO3+C(s�����ʯ)
���������գ�
��1��������Ӧ���漰��Ԫ�ص�ԭ�Ӱ뾶�Ӵ�С��˳��Ϊ____��
��2����֤��̼Ԫ������Ԫ�طǽ���ǿ������ʵ��___��ѡ���ţ���
a.���������ˮ��������� b.����Ԫ�ص���̬�⻯��ķе�
c.CO2��Ԫ�صĻ��ϼ� d.�����⻯�����ȷֽ���¶�
��3����ѹ�£���ѧ�ҳɹ��ؽ�CO2ת��Ϊ��������SiO2�ṹ��ԭ�Ӿ��壬�Ƚ�SiO2��CO2������ԭ�Ӿ�����۷е�ߵͣ���˵�����ɣ�___��
��ѹ | �۵㣨�棩 | �е㣨�棩 |
�� | 97.8 | 882.9 |
Na2CO3 | 851 | 1850�ֽ� |
���ʯ | 3550 | �� |
ʯī | 3850 | 4250 |
��4������2L�ܱ������У�10min�ڽ����Ƽ�����0.2mol����CO2��ƽ����Ӧ����Ϊ___���÷�Ӧ�ڳ�ѹ1000���½��У������ұ����ݣ��÷�Ӧ��ƽ�ⳣ������ʽK=___��
��5������2L�ܱ������У���ѹ��1000���£���ʼʱ��������������˵���÷�Ӧ�Ѵﵽƽ��״̬����____��
a.�����ƽ��Ħ���������� b.3v����(Na)=4v����(CO2)
c.������ܶȲ��� d.![]() �ı�ֵ����
�ı�ֵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪһ��������ͼ����ͼ���������������ʾ��ɹ���Ϊһ�࣬�ཻ����A��B��C��DΪ����Ӧ�ķ������ݴ��ţ���������ݴ����жϲ���ȷ���ǣ� ��
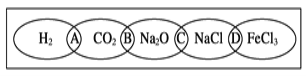
A.����A�����ǵ����B.����B����ˮ��Һ���ܵ��綼�ǵ����
C.����C�����ƵĻ�����D.����D������ɶ��ǽ����Ȼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪��Ӧ����SO3��H2O=H2SO4
��Cl2��H2O=HCl��HClO
��2F2��2H2O=4HF��O2
��2Na��2H2O=2NaOH��H2��
��2Na2O2��2H2O=4NaOH��O2��
��CaCO3+ CO2��H2O= Ca��HCO3��2
������Ӧ�в�����������ԭ��Ӧ����_________������ţ���ͬ����H2O����������____��H2O����ԭ����__________������������ԭ��Ӧ�������е�H2O�Ȳ����������ֲ�����ԭ����___________��
��2����˫���ű�ʾ���з�Ӧ����ת�����
�� KClO3 + 6HCl��Ũ��= KCl + 3Cl2��+ 3H2O
__________________________________
�� 3KOH + P4 + 3H2O = 3KH2PO2 + PH3��
___________________________________
��1����ƽ���з�Ӧ����ʽ
���뽫5������N2O��FeSO4��Fe��NO3��3��HNO3��Fe2��SO4��3�ֱ����������Ӧ�ĺ����ϣ�����ƽ�䷴Ӧ��__________��__________��__________��__________��__________��____N2O��
���ں���ͭ��ʱ���Ȼ�麟�ȥͭ�����������ͭ�Ա㺸�ӣ���ƽ�䷴Ӧ��
____CuO��___NH4Cl ![]() ____Cu��___CuCl2��___N2����___H2O��
____Cu��___CuCl2��___N2����___H2O��
��2����֪��2Fe3����2I��=2Fe2����I2��2Fe2����Br2=2Fe3����2Br����
�ٺ���1 mol FeI2��2 mol FeBr2����Һ��ͨ��2 mol Cl2����ʱ��������������_______�������������ӵ����ʵ����ֱ���_______________��
������a mol FeI2��b mol FeBr2����Һ��ͨ��c mol Cl2����I����Fe2����Br����ȫ������ʱ��cΪ_______���ú�a��b�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��8.8g FeS��400mL 1 mol/L������Һǡ����ȫ��Ӧ����Ӧ�����ΪFe2(SO4)3��Fe(NO3)3, X��H2O����XΪ�� ��
A.N2B.NOC.N2OD.NO2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com