
【题目】Ⅰ.(1)已知反应:①SO3+H2O=H2SO4
②Cl2+H2O=HCl+HClO
③2F2+2H2O=4HF+O2
④2Na+2H2O=2NaOH+H2↑
⑤2Na2O2+2H2O=4NaOH+O2↑
⑥CaCO3+ CO2+H2O= Ca(HCO3)2
上述反应中不属于氧化还原反应的有_________(填序号,下同);H2O被氧化的是____,H2O被还原的是__________,属于氧化还原反应,但其中的H2O既不被氧化,又不被还原的是___________。
(2)用双线桥表示下列反应电子转移情况
① KClO3 + 6HCl(浓)= KCl + 3Cl2↑+ 3H2O
__________________________________
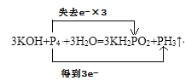
② 3KOH + P4 + 3H2O = 3KH2PO2 + PH3↑
___________________________________
Ⅱ.(1)配平下列反应方程式
①请将5种物质N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,并配平其反应。__________+__________→__________+__________+__________+____N2O↑
②在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,配平其反应。
____CuO+___NH4Cl ![]() ____Cu+___CuCl2+___N2↑+___H2O。
____Cu+___CuCl2+___N2↑+___H2O。
(2)已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
①含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是_______,被氧化的离子的物质的量分别是_______________。
②若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,c为_______(用含a、b的代数式表示)。
【答案】①⑥ ③ ④ ②⑤ 
 30HNO3 24FeSO4; 8Fe(NO3)3 8Fe2(SO4)3 15H2O 3 4 2 3 1 1 4 I、Fe2+ 2mol、2mol
30HNO3 24FeSO4; 8Fe(NO3)3 8Fe2(SO4)3 15H2O 3 4 2 3 1 1 4 I、Fe2+ 2mol、2mol ![]()
【解析】
根据氧化还原反应中化合价的变化分析判断氧化剂和还原剂;根据电子转移守恒配平氧化还原反应并用双线桥法表示;根据氧化性强弱分析判断氧化还原反应发生的顺序,并根据电子转移守恒进行相关计算。
I.(1)只有①⑥反应中没有元素的化合价变化,不属于氧化还原反应;只有③水中O元素的化合价升高,水被氧化;只有④水中H元素的化合价降低,水被还原化;只有②⑤中属于氧化还原反应,但水中H、O元素的化合价不变,则H2O既不被氧化,又不被还原,故答案为:①⑥;③;④;②⑤;
(2)①该反应中,氯酸钾中氯元素的化合价由+5价变为0价,所以氯酸钾是氧化剂,HCl中Cl元素化合价由1价升高到0价,被氧化,既是氧化产物也是还原产物,得电子与失电子个数相等,比值为1:1,氧化产物和还原产物的质量之比是5:1,只有Cl元素化合价发生变化,当有3molCl2生成时,转移5mol电子,则电子转移的方向和数目为 ,故答案为:
,故答案为: ;
;
②该反应中P元素化合价由0价升高为KH2PO2中的+1价,降低为PH3中的-3价,P4既是氧化剂也是还原剂,根据转移电子数守恒可以知,1molP4发生反应时,转移电子数为3mol,得电子与失电子的原子数比为1:3,用双线桥法表示为: ,故答案为:
,故答案为: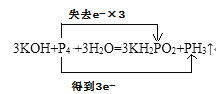 ;
;
Ⅱ.(1)①所给的物质组合中,HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为N2O,能将还原性的FeSO4氧化为Fe2(SO4)3,根据氢原子守恒,有水生成,根据化合价升降相等和原子守恒配平后发生的反应为:30HNO3+24FeSO4=8Fe(NO3)3+8Fe2(SO4)3+15H2O+3N2O,故答案为:30HNO3;24FeSO4;8Fe(NO3)3;8Fe2(SO4)3;15H2O;3;
②Cu由+2价降低为0,N元素的化合价由3价升高为0,由电子守恒、原子守恒可知,NH4Cl失去3个电子,而铜得到2个电子,得失电子守恒,NH4Cl前面系数为2,铜前面的系数为3,再结合原子守恒可知,反应为4CuO+2NH4Cl=3Cu+CuCl2+N2↑+4H2O,故答案为:4;2;3;1;1;4;
(2)①向含有1molFeI2和2molFeBr2的溶液中通入2molCl2,先发生反应2I+Cl2=I2+2Cl,2mol碘离子完全反应需要氯气1mol,然后发生反应Cl2+2Fe2+=2Cl+2Fe3+,1mol氯气反应需要亚铁离子的物质的量是2mol,溶液中含有3mol亚铁离子,参加反应的亚铁离子的物质的量是2mol,所以溶液中还剩余亚铁离子1mol,所以被氧化的离子是2molI、2molFe2+,被氧化的I、Fe2+的物质的量分别是2mol、2mol,故答案为:I、Fe2+;2mol、2mol;
②amolFeI2完全被氧化转移3amol电子,bmolFeBr2完全被氧化转移3bmol电子,由得失电子守恒可知,当I、Fe2+、Br完全被氧化时,消耗氯气为![]() ×(3a+3b)mol,即
×(3a+3b)mol,即![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 22.4LCl2溶于足量水,所得溶液中Cl2、Cl-、HClO和ClO-四种微粒总数为NA
B. 标准状况下,38g3H2O2中含有3NA共价键
C. 常温下,将5.6g铁块投入足量浓硝酸中,转移0.3NA电子
D. 0.1molL-1MgCl2溶液中含有的Mg2+数目一定小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图:
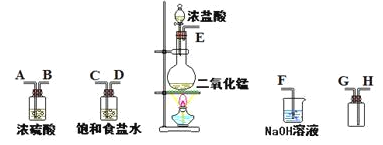
(1)连接上述仪器的正确顺序是(填各接口处的字母):E接 , 接 , 接 , 接 。___
(2)在装置中饱和食盐水起的作用是___。
(3)化学实验中检验是否有Cl2产生常用试纸为___。
(4)写出氢氧化钠溶液中反应的离子方程式___。
(5)将0.2molMnO2和500mL12mol/L盐酸混合后缓缓加热,MnO2反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀的物质的量为___(不考虑盐酸的挥发和氯气的溶解)。
(6)实验室也可以用K2Cr2O7和盐酸反应制取Cl2,配平反应方程式,并指出氧化剂和还原剂的物质的量之比是___,________K2Cr2O7+________HCl=________KCl+________CrCl3+________Cl2↑+________H2O
(7)已知还原性:SO32->I-。向含amolKI和amolK2SO3的混合液中通入bmolCl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是___
A.当a≥b时,发生的离子反应为SO32-+Cl2+H2O=SO42-+2H++2Cl-
B.当5a=4b时,发生的离子反应为4SO32-+2I-+5Cl2+4H2O=4SO42-+I2+8H++10Cl-
C.当a<b<![]() 时,溶液中SO42-、I-与Cl-的物质的量之比为a:(3a-2b):2b
时,溶液中SO42-、I-与Cl-的物质的量之比为a:(3a-2b):2b
D.当a≤b≤![]() 时,反应中转移电子的物质的量n(e-)为amol≤n(e-)≤3amol
时,反应中转移电子的物质的量n(e-)为amol≤n(e-)≤3amol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石的主要成分是Cu2(OH)2CO3(含Fe2O3、FeCO3、Al2O3、SiO2杂质),工业上用孔雀石制备硫酸铜的第一步需用过量的硫酸溶解并过滤。常温下,分别取滤液并向其中加入指定物质,反应后的溶液中大量存在的离子组正确的是
A. 加入过量氨水:Fe3+、NH4+、SO42-、OH-
B. 加入过量NaClO溶液:Fe2+、Na+、ClO-、SO42-
C. 加入过量NaOH溶液:Na+、AlO2-、SO42-、OH-
D. 加入过量NaHCO3溶液:Na+、Al3+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能达到目的的是
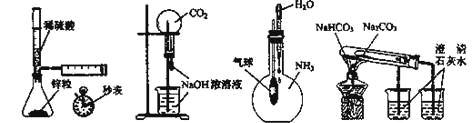
A B C D
A. 测定一定时间内生成H2的反应速率B. 用CO2做喷泉实验
C. 验证NH3易溶于水D. 比较Na2CO3和NaHCO3的热稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的含量影响钢铁性能。一种测定硫含量的方法是将钢样中硫转化为二氧化硫气体,再用测硫装置进行测定。某测定硫含量的流程如下:
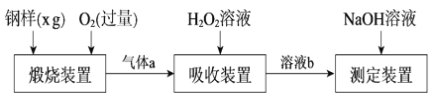
(1)气体a的主要成分有CO2、______、______。
(2)若钢样中硫以FeS的形式存在,煅烧装置中发生的化学反应为3FeS+5O2 ![]() 1______ +3______。___________
1______ +3______。___________
(3)吸收装置中,H2O2氧化SO2的化学方程式是_________________。
(4)用NaOH溶液中和生成的溶液b,消耗z mLNaOH溶液,若消耗1 mLNaOH溶液相当于硫的质量为y g,则该钢样中硫的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用如图所示装置进行乙醇的催化氧化实验。

(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式________。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该反应是________反应(填“吸热”或“放热”)。
(2)甲和乙两个水浴作用不相同:甲的作用是________;乙的作用是________。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是________________,集气瓶中收集到的主要成分是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】-定条件下,各微粒有如下变化(示意图如下),其中![]() 和O代表短周期前10号不同元素的原子。反应物
和O代表短周期前10号不同元素的原子。反应物![]() 为液体,生成物均为气体。
为液体,生成物均为气体。
![]()
下列有关判断错误的是
A.反应物![]() 的名称是乙烯
的名称是乙烯
B.上述反应的氧化产物为![]()
C.反应前后,一定是共价键的断裂与生成
D.上述反应方程式,物质之间没有确定的系数比
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com