
【题目】-定条件下,各微粒有如下变化(示意图如下),其中![]() 和O代表短周期前10号不同元素的原子。反应物
和O代表短周期前10号不同元素的原子。反应物![]() 为液体,生成物均为气体。
为液体,生成物均为气体。
![]()
下列有关判断错误的是
A.反应物![]() 的名称是乙烯
的名称是乙烯
B.上述反应的氧化产物为![]()
C.反应前后,一定是共价键的断裂与生成
D.上述反应方程式,物质之间没有确定的系数比
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)已知反应:①SO3+H2O=H2SO4
②Cl2+H2O=HCl+HClO
③2F2+2H2O=4HF+O2
④2Na+2H2O=2NaOH+H2↑
⑤2Na2O2+2H2O=4NaOH+O2↑
⑥CaCO3+ CO2+H2O= Ca(HCO3)2
上述反应中不属于氧化还原反应的有_________(填序号,下同);H2O被氧化的是____,H2O被还原的是__________,属于氧化还原反应,但其中的H2O既不被氧化,又不被还原的是___________。
(2)用双线桥表示下列反应电子转移情况
① KClO3 + 6HCl(浓)= KCl + 3Cl2↑+ 3H2O
__________________________________
② 3KOH + P4 + 3H2O = 3KH2PO2 + PH3↑
___________________________________
Ⅱ.(1)配平下列反应方程式
①请将5种物质N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,并配平其反应。__________+__________→__________+__________+__________+____N2O↑
②在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,配平其反应。
____CuO+___NH4Cl ![]() ____Cu+___CuCl2+___N2↑+___H2O。
____Cu+___CuCl2+___N2↑+___H2O。
(2)已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
①含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是_______,被氧化的离子的物质的量分别是_______________。
②若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,c为_______(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】8.8g FeS与400mL 1 mol/L硝酸溶液恰好完全反应,反应后产物为Fe2(SO4)3和Fe(NO3)3, X、H2O,则X为( )
A.N2B.NOC.N2OD.NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种位于不同主族的短周期元素X、Y、Z、W的原子序数依次增大,![]() 的内层电子与最外层电子数之比为2:5,Z和W位于同一周期。Z与W组成的化合物是常用的调味品,也是重要的医用药剂,工业上电解该化合物的熔融物可制得Z单质,Y和Z可形成两种离子化合物,这两种离子化合物的阴离子与阳离子数之比均为1:2。下列说法正确的是
的内层电子与最外层电子数之比为2:5,Z和W位于同一周期。Z与W组成的化合物是常用的调味品,也是重要的医用药剂,工业上电解该化合物的熔融物可制得Z单质,Y和Z可形成两种离子化合物,这两种离子化合物的阴离子与阳离子数之比均为1:2。下列说法正确的是
A. 四种元素中至少有两种金属元素
B. 四种元素的常见氢化物中熔点最高的是![]() 的氢化物
的氢化物
C. 四种元素形成的简单高子中,离子半径最小的是元素![]() 形成的离子
形成的离子
D. 常温下,![]() 三种元素形成的化合物的水溶液的
三种元素形成的化合物的水溶液的![]() 小于7
小于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为金属单质,下列物质相互转化如图所示:

试回答:
(1)写出B的化学式_______,D的化学式______。
(2)写出由E转变成F的化学方程式______。
(3)检验G溶液中阳离子的试剂为______,写出发生反应的离子方程式______。
(4)向G溶液加入A的有关离子反应方程式______。
(5)某同学取B的溶液酸化后加入碘化钾淀粉溶液,在空气中放置一会儿变为蓝色,写出与上述变化过程相关的离子方程式______,______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着工农业发展,NH4Cl的价格低迷、需求降低导致利用“侯氏制碱法”生产的碱厂出现亏损。“新联合制碱法”应运而生,流程如下:
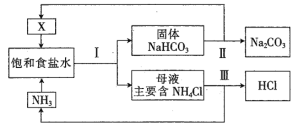
(1)写出气体X的结构式_______________________。
(2)上述工艺流程中参与循环使用的气体有____________、____________。
(3)所得产品Na2CO3中不会含有NH4Cl,原因是__________________(用化学方程式表示)。
(4)过程III以MgO为催化剂进行转化,示意图如下:
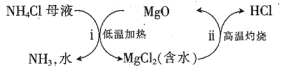
①步骤ii实际上要经过加热和高温两步反应,“加热”步骤制得HCl,“高温”步骤得到MgO,其化学方程式分别为__________________、________。
②过程III分两步得到NH3和HCl,比一步得到NH3和HCl的好处是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知MgO、MgCl2的熔点分别为2800℃、604℃,将MgO、MgCl2加热熔融后通电电解,都可得到金属镁。海水中含有MgCl2,工业上从海水中提取镁,正确的方法是 ( )
A. 海水![]() Mg(OH)2
Mg(OH)2![]() Mg
Mg
B. 海水![]() MgCl2溶液
MgCl2溶液![]() MgCl2熔融
MgCl2熔融![]() Mg
Mg
C. 海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
D. 海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液
MgCl2溶液![]() MgCl2熔融
MgCl2熔融![]() Mg
Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:(己知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃
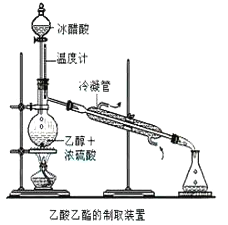
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是______________。
(2)在烧瓶中加入一定比例的乙醇和浓硫酸的混合液的方法是:_______________。
(3)在该实验中,若用lmol乙醇和lmol乙酸在浓硫酸作用下加热,充分反应,能否生成lmol乙酸乙酯?原因是___________________。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。

试剂a是__________,试剂b是_______________;分离方法①是________,分离方法②是__________,分离方法③是________________。
(5)在得到的A中加入无水碳酸钠粉末,振荡,目的是____________________。
(6)写出C→D反应的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(s)![]() 2B(g)+C(g)+D(g)已达到平衡状态的是( )
2B(g)+C(g)+D(g)已达到平衡状态的是( )
①混合气体的压强②混合气体的密度③A的物质的量浓度④混合气体总物质的量 ⑤混合气体的平均相对分子质量⑥v(C)与v(D)的比值 ⑦混合气体总质量 ⑧混合气体总体积
A.③④⑤⑥⑧B.①②⑥⑦C.①②④⑦D.①③⑤⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com