
【题目】SO2溶于水生成亚硫酸,亚硫酸的酸性强于次氯酸。选择下面的装置和药品来探究亚硫酸与次氯酸的酸性强弱。仪器选择、连接顺序正确的是(SO2发生装置己略去,且通入的SO2纯净)( )
①NaHCO3溶液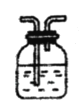 ②品红溶液
②品红溶液 ③酸性KMnO4溶液
③酸性KMnO4溶液 ④漂白粉溶液
④漂白粉溶液
A.→②→④B.→①→③→②→④C.→②→①→④→③D.→①→④→②
【答案】B
【解析】
次氯酸具有强氧化性,二氧化硫具有还原性,不能利用二氧化硫与次氯酸钙直接反应判断亚硫酸与次氯酸的酸性强弱,先验证亚硫酸酸性比碳酸强,再结合碳酸酸性比HClO强碱性判断。先将SO2通入碳酸氢钠溶液,验证亚硫酸酸性比碳酸强,用酸性高锰酸钾溶液氧化除去二氧化碳中的二氧化硫,用品红溶液检验二氧化碳中二氧化硫是否除尽,最后通入漂白粉溶液,据此分析。
根据上述分析可知,应先将SO2通入①碳酸氢钠溶液,验证亚硫酸酸性比碳酸强,用③酸性高锰酸钾溶液氧化除去CO2中的SO2,用②品红溶液检验CO2中SO2是否除尽,最后通入④漂白粉溶液,证明碳酸的酸性大于次氯酸,从而得出酸性:亚硫酸>碳酸>次氯酸,所以装置连接顺序为→①→③→②→④,
故选:B。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】(1)在![]() H、
H、![]() H、
H、![]() H、
H、![]() Mg、
Mg、![]() Mg和
Mg和![]() Cu中共有____种元素,_____种原子。
Cu中共有____种元素,_____种原子。
(2)有下列各组物质:A.O2和O3 B.12C和13C C.CH3—CH2—CH2—CH3和![]() D.
D.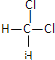 和
和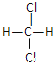 E.甲烷和庚烷。
E.甲烷和庚烷。
①_________组两物质互为同位素。
②__________组两物质互为同素异形体。
③_________组两物质属于同系物。
④_________组两物质互为同分异构体。
⑤_________组中两物质是同一物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)铅蓄电池的总反应为:Pb + PbO2 + 2H2SO4 ![]() 2PbSO4 + 2H2O,放电时,负极反应式为___________,充电时,阳极反应式为___________。
2PbSO4 + 2H2O,放电时,负极反应式为___________,充电时,阳极反应式为___________。
(2)利用如图装置,可以模拟铁的电化学防护。
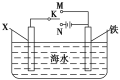
①若X为石墨,为减缓铁的腐蚀,将开关K置于N处,该电化学防护法称为___________。
②若X为锌,开关K置于M处,该电化学防护法称为__________。
(3)我国的科技人员为了消除SO2的污染,利用原电池原理,设计如图2装置用SO2和O2制备硫酸,电极A、B为多孔的材料。
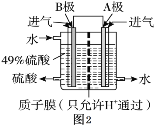
① A极的电极反应式是________。
② B极的电极反应式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
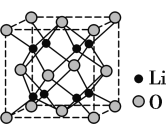
【题目】(1)Li2O具有反萤石结构,晶胞如图所示。已知晶胞参数为0.466 5 nm,阿伏加德罗常数的值为NA,则Li2O的密度为__________ g·cm-3(列出计算式)。
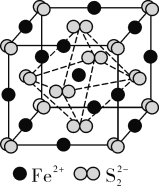
(2)FeS2晶体的晶胞如图所示。晶胞边长为a nm、FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为________g·cm-3;晶胞中Fe2+位于S![]() 所形成的正八面体的体心,该正八面体的边长为____nm。
所形成的正八面体的体心,该正八面体的边长为____nm。
(3)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。R的晶体密度为d g·cm-3,其立方晶胞参数为a nm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M,则y的计算表达式为______________。
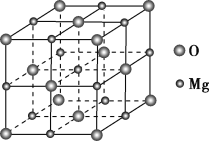
(4)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为________nm。MnO也属于NaCl型结构,晶胞参数为a′=0.448 nm,则r(Mn2+)为____________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质属于分子晶体的是( )
A. 熔点是10.31℃,液态不导电,水溶液能导电
B. 熔点是1070℃,固态不导电,熔融状态能导电,易溶于水
C. 熔点3550℃,不溶于水,不导电
D. 熔点是97.80℃,质软,固态可导电,密度是0.97g·cm﹣3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.请回答下列问题。
(1)氮、磷、砷的电负性的大小关系是 ,砷原子M层电子排布式为 。
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为 ,该化学键能够形成的原因是 。
(3)已知:
CH4 | SiH4 | NH3 | PH3 | |
沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
分解温度(K) | 873 | 773 | 1073 | 713.2 |
分析上表中四种物质的相关数据,请回答:
① CH4和SiH4比较,沸点高低的原因是 。
② NH3和PH3比较,分解温度高低的原因是 。
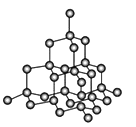
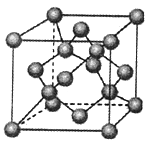
(4)金刚石是原子晶体,含有的最小环是六元环(如右边图),每个碳原子连接 个六元环,如左边图是金刚石的晶胞,若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,碳原子在晶胞中的空间占有率 (不要求计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚铁在空气中灼烧得到铁的氧化物A和一种气体。某学习小组为了探究该氧化物A的组成设计了两种实验方案:
方案Ⅰ
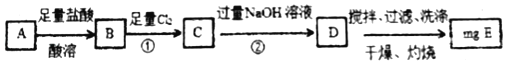
(1)若该方案中①通入Cl2不足量,小组成员认为可以通过在空气中充分搅拌D而最终实现准确测定,他的依据是_____(用化学方程式表示)
(2)若氧化物A的质量是7.8400g,E的质量为8.0000g根据数据计算化合物A的化学式为_____。
方案Ⅱ
①称取ag氧化物A样品溶于足量稀硫酸,并配成100mL溶液。
②取20.00 mL该溶液于锥形瓶中,滴加几滴KSCN溶液,溶液变红色;再滴加双氧水至红色刚好褪去,同时产生少量气泡(资料显示SCN-可被H2O2氧化,产物为N2、CO2、SO42﹣)
③待气泡消失后,用 b mol/LKI标准溶液滴定锥形瓶中的Fe3+,滴定终点时消耗cmL KI标准溶液。
(3)该方案用到的定量仪器有量筒、分析天平、酸式滴定管、_____。
(4)步骤②中滴加KSCN溶液的目的是_____。
(5)补充完整该实验步骤③用到的酸式滴定管的润洗操作:关闭滴定管旋塞,从上口注入3﹣5mL待装液,_____,重复2﹣3次。
(6)步骤③能否选用淀粉作指示剂_____。(填“能”或“否”)
(7)有的同学通过查阅相关资料对该小组的实验设计进行了评价,以下说法合理的是_____
A.资料显示:HSCN有剧毒,易挥发。因此该方案步骤②可能因产生HSCN而不符合实验安全性的要求。
B.步骤②若加入H2O2过量,后续步骤不加以处理也不会对实验结果造成任何影响。
C.资料显示:Fe3+和I﹣之间的反应是明显的可逆反应,这样步骤③就会造成滴定测定不准确
(8)有的同学对碳酸亚铁的获得产生了兴趣。通过查阅资料发现碳酸亚铁可通过碳酸氢钠和硫酸亚铁发生Fe2++2HCO3﹣FeCO3↓+H2CO3制得,请计算该反应的平衡常数K=_____(mol/L)﹣2可能用到的缴据如下:Ksp(FeCO3)=3.20×10﹣11,H2CO3的Ka1=4.30×10﹣7,Ka2=5.61×10﹣11。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用pH传感器探究NaOH溶液与硫酸、硫酸铜混合溶液发生反应的离子反应顺序,绘得三份曲线图如图。已知实验使用的NaOH溶液浓度和滴速相同;硫酸溶液和硫酸铜溶液浓度相同;混合溶液中两溶质的浓度也相同。
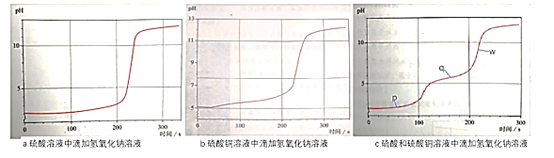
以下解读错误的是
A.三个时点的c(Cu2+):p>q>w
B.w点:c(Na+)>c(SO42-)>c(Cu2+)>c(H+)
C.混合溶液中滴加NaOH溶液,硫酸先于硫酸铜发生反应
D.q点时溶液离子浓度:c(SO42-)+c(OH-)=c(Cu2+)+c(H+)+c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
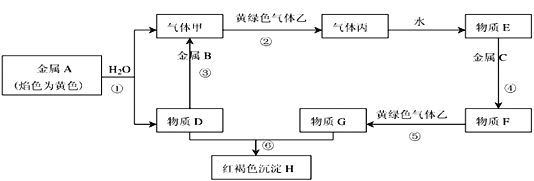
请回答下列问题:
(1)写出下列物质的化学式:丙_________、乙_________。
(2)图中反应①②③④⑤⑥中属于氧化还原反应的有:_____________________ ,属于置换反应反应的有:_______________ 。
(3)写出反应⑤的离子方程式:_____________________;
(4)写出反应①的化学方程式_______________________________ ,当得到标准状况 下的甲气体2.24L,则参加反应的金属A____________ g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com