
【题目】已知原子序数,可推断原子的是( )
①质子数②核电荷数③核外电子数④元素在周期表中的位置
A. ①②③B. ①③④C. ②③④D. 全部
 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】【化学——选修5:有机化学基础】
有机物G(分子式C13H18O2)是一种香料,下图是该香料的一种合成路线。

已知:①E能够发生银镜反应,l mol E能够与2mol H2完全反应生成F;
![]()
③有机物D的摩尔质量为88g/mol,分子式为C4H8O2,其核磁共振氢谱有3组峰:
④有机物F是苯甲醇的同系物,苯环上只有一个无支链的侧链。
回答下列问题:
(1)用系统命名法命名有机物B:_____________________________。
(2)E的结构简式为:__________________________________。
(3)C与新制的Cu(OH)2悬浊液反应的化学方程式为:___________________。
(4)有机物C可与银氨溶液反应,配制银氨溶液所需试剂为:__________。
(5)已知有机物甲符合下列条件:①为芳香族化合物;②与F是同分异构体;③能被催化氧化成醛。符合上述条件的甲有_________种。其中满足苯环上有3个侧链,且核磁共振氢谱有5组峰,峰面积之比为6:2:2:l:1的有机物的结构简式为________________。
(6)以丙烯为原料合成D的路线如下:

X的结构简式为:________________________,步骤II的反应条件为:________________。步骤IV的反应类型为:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,实验室利用如图所示装置,通过测量电压求算Ksp(AgCl)。工作一段时间后,两电极质量均增大。下列说法正确的是

A. 右池中的银电极作负极
B. 总反应为Ag++Cl-=AgCl
C. 正极反应为Ag-e-=Ag+
D. 盐桥中的NO3-向右池方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物的结构(键线式)及球棍模型如下:

该有机分子的核磁共振氢谱图如下(单位是ppm):
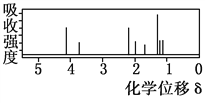
下列关于该有机物的叙述正确的是 ( )
A. 该有机物不同化学环境的氢原子有8种
B. 该有机物属于芳香化合物
C. 键线式中的Et代表的基团为—CH3
D. 该有机物在氢氧化钠醇溶液加热的情况下能发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 含有共价键的化合物必是共价化合物
B. 阴、阳离子间通过静电引力所形成的化学键是离子键
C. 化学变化过程,一定会破坏旧的化学键,同时形成新的化学键
D. 液态氯化氢中存在H+和Cl-,所以能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2 CH≡CH ——> CH2=CH—C≡CH(乙烯基乙炔)两分子乙炔反应得到该物质是合成橡胶的重要原料,下列关于该物质的判断正确的是 ( )
A. 该物质既是H2C===CH2的同系物,又是HC≡CH的同系物
B. 该物质只能使酸性KMnO4溶液褪色,不能使溴水因反应褪色
C. 该物质与1mol的H2加成后,只能生成一种物质
D. 该物质经加成、加聚反应后的产物是氯丁橡胶(![]() )的主要成分
)的主要成分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组探究SO2的一些性质。
[探究一]:SO2能否被BaCl2溶液吸收。

甲、乙两同学分别设计如下装置甲和装置乙进行探究
甲、乙两同学实验时观察到各仪器中的现象如下:
A | B | C | D | |
装置甲中的现象 | Na2SO3固体表面有气泡.瓶中白雾 | 白色沉淀 | ----- | ------ |
装置乙中的现象 | Na2SO3固体表面有气泡.瓶中白雾 | 有气泡 | 有气泡 | 品红褪色 |
回答下列问题:
(1)甲同学经过后续实验确证了B中白色沉淀是BaSO4.甲同学的后续实验操作是____
(2)乙同学分析装置甲中产生BaSO4的可能原因有:
①A中产生的白雾是硫酸的酸雾,进入B中与BaCl2溶液反应生成BaSO4沉淀。
②________________________(用离子方程式表示)。
(3)装置乙中B中所盛试剂是___;乙同学在滴加浓硫酸之前的操作是___________
(4)通过上述实验,得出的结论是________________________
[探究二]:SO2与FeCl3溶液的反应
查阅资料:①Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+;②生成Fe(HSO3)2+离子的反应为可逆反应。实验步骤为:
步骤I | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
步骤II | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
回答下列问题:
(5)当SO2通入到FeCl3(未用盐酸酸化)溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。则溶液由棕黄色变成红棕色的原因是_________;写出溶液由红棕色变为浅绿色时发生反应的离子方程式___________
(6)通过实验可知_____和________可缩短浅绿色出现的时间。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com