
【题目】表示下列变化的化学用语正确的是
A.氨水显碱性:NH3·H2O ![]() NH4++OH-
NH4++OH-
B.醋酸溶液显酸性:CH3COOH = CH3COO-+ H+
C.NaHCO3溶液显碱性:HCO3-+H2O ![]() CO32- + OH-
CO32- + OH-
D.FeCl3溶液显酸性:Fe3++3H2O = Fe(OH)3↓+3H+
科目:高中化学 来源: 题型:
【题目】下面有关化学反应速率和限度的图象和实验结论表达均正确的是![]()
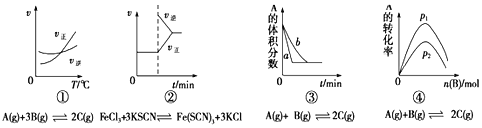
A.图①是其他条件一定时反应速率随温度变化的图象,图象表明该反应的![]()
B.图②是在平衡体系的溶液中加入少量KCl晶体后化学反应速率随时间的变化
C.图③可能是压强对化学平衡的影响
D.图④是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷及其化合物在化工生产中有着广泛的应用,请对下列问题作答。
![]() 有多种单质,其中一种叫白磷,分子式为
有多种单质,其中一种叫白磷,分子式为![]() ,结构如图Ⅱ所示,
,结构如图Ⅱ所示,![]() 分子的活泼性比
分子的活泼性比![]() 分子______
分子______![]() 填强或弱
填强或弱![]() 。
。
![]() 白磷燃烧的能量变化图和产物结构如图Ⅰ、图Ⅱ所示,假设
白磷燃烧的能量变化图和产物结构如图Ⅰ、图Ⅱ所示,假设![]() 、
、![]() 、
、![]() 的键能分别为x、y、z,x、y、z、a、b、c均为正值,利用图中信息求出
的键能分别为x、y、z,x、y、z、a、b、c均为正值,利用图中信息求出![]() 的键能的表达式为______
的键能的表达式为______

![]() 已知含氧酸分子中只有羟基中的氢原子才能发生电离。
已知含氧酸分子中只有羟基中的氢原子才能发生电离。![]() 具有较强还原性而且该酸无酸式盐,分子中只含一个羟基,写出其电离方程式______
具有较强还原性而且该酸无酸式盐,分子中只含一个羟基,写出其电离方程式______
![]() 可用于化学镀镍。配平并完成下列化学方程式:
可用于化学镀镍。配平并完成下列化学方程式:
______![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]() ______
______
![]() 磷酸是一种三元中强酸,已知
磷酸是一种三元中强酸,已知![]() ,
,![]() ,
,![]() ,
,![]() 的水溶液显______性,解释原因______。
的水溶液显______性,解释原因______。
![]() 是重要的化工原料,某温度下,反应
是重要的化工原料,某温度下,反应![]() 的化学平衡常数
的化学平衡常数![]() ,在1L的密闭容器中加入
,在1L的密闭容器中加入![]() ,平衡后
,平衡后![]() 的浓度是______。
的浓度是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】列各组离子一定能在指定环境中大量共存的是( )
A.在c(H+)=10-10 mol/L的溶液中 Al3+ 、NH![]() 、Cl- 、NO
、Cl- 、NO![]()
B.pH值为13的溶液 K+ 、SO![]() 、Na+、S2-
、Na+、S2-
C.水电离出来的c(H+)=10-12mol/L的溶液 K+、NH4+、Cl-、ClO-
D.甲基橙呈红色的溶液中 Fe3+、Na+ 、SO42-、CO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组针对反应![]() 进行研究。下列研究结论正确的是
进行研究。下列研究结论正确的是
A.若向绝热恒容密闭容器中通入一定量的![]() 和
和![]() 进行反应,正反应速率随时间变化的曲线如图Ⅰ所示,则A点反应达到平衡
进行反应,正反应速率随时间变化的曲线如图Ⅰ所示,则A点反应达到平衡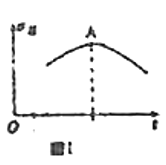
B.若恒温条件下进行反应,Y的平衡转化率![]() 与压强
与压强![]() 的关系如图Ⅱ所示,则B点
的关系如图Ⅱ所示,则B点![]()
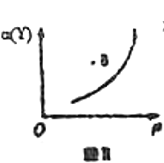
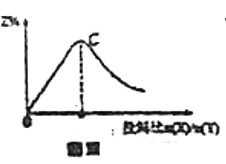
C.若恒温恒容,改变X与Y的投料比![]() 进行反应,平衡时Z的百分含量
进行反应,平衡时Z的百分含量![]() 随
随![]() 变化的曲线如图Ⅲ,则C点
变化的曲线如图Ⅲ,则C点![]()
D.若恒容条件下投入一定量的X和Y边加热边进行反应,X的体积分数![]() 随温度的变化如图Ⅳ所示,则该反应反应物的总能量高于生成物的总能量
随温度的变化如图Ⅳ所示,则该反应反应物的总能量高于生成物的总能量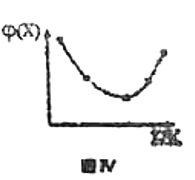
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
下列说法正确的是
A. 此时刻正反应速率大于逆反应速率
B. 若起始时加入2a mol CH3OH,则达到平衡时CH3OH的转化率增大
C. 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态
D. a=1.64
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应![]() 为放热反应:
为放热反应:
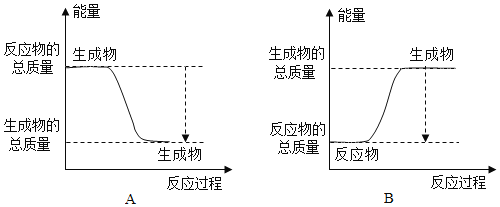
①下图能正确表示该反应中能量变化的是______;
②根据下表数据,计算生成1mol![]() 时该反应放出的热量为______kJ;
时该反应放出的热量为______kJ;
化学键 |
|
|
|
断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3mol![]() 和1mol
和1mol![]() 通入容积为2L的密闭容器中发生反应,5min达到平衡,测得
通入容积为2L的密闭容器中发生反应,5min达到平衡,测得![]() ,则0至5min时
,则0至5min时![]() ______,达到平衡时
______,达到平衡时![]() 的转化率为______。
的转化率为______。
(2)某兴趣小组为研究原电池原理,设计如图装置。
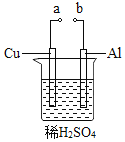
①![]() 和b用导线连接,Cu极为原电池______极
和b用导线连接,Cu极为原电池______极![]() 填“正”或“负”
填“正”或“负”![]() ,电极反应式是:______;
,电极反应式是:______;
Al极发生______![]() 填“氧化”或“还原”
填“氧化”或“还原”![]() 反应,其电极反应式为:______,溶液中
反应,其电极反应式为:______,溶液中![]() 移向______。
移向______。![]() 填“Cu”或“Al”极
填“Cu”或“Al”极![]() 溶液pH______
溶液pH______![]() 填增大或减小
填增大或减小![]() ;当负极金属溶解
;当负极金属溶解![]() 时,______
时,______![]() 电子通过导线。
电子通过导线。
②不将a、b连接,请问如何加快Al与稀硫酸的反应速率?______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2经催化加氢可合成乙烯:2CO2 (g) +6H2 (g) ![]() C2H4(g)+4H2O(g)。0.1 MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图。下列叙述不正确的是
C2H4(g)+4H2O(g)。0.1 MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图。下列叙述不正确的是

A. 该反应的△H<0
B. 曲线b代表H2O
C. N点和M点所处状态的c(H2)不一样
D. 其它条件不变,T1℃、0.2 MPa下反应达平衡时c(H2)比M点大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铈(Ce)是一种重要的稀土元素。
(1) 工业上用氟碳铈矿(主要成分为CeFCO3)制备CeO2。焙烧过程中发生的主要反应的化学方程式为________。

(2) 已知CeCl3·7H2O在空气中易被氧化成四价铈,反应如下:
① CeCl3·7H2O(s)=CeCl3(s)+7H2O(g);ΔH1=a kJ·mol-1
② 4CeCl3(s)+O2(g)+14H2O(g)=4Ce(OH)4(s)+12HCl(g);ΔH2=b kJ·mol-1
③ Ce(OH)4(s)=CeO2(s)+2H2O(g);ΔH3=c kJ·mol-1
则4CeCl3·7H2O(s)+O2(g)=4CeO2(s)+12HCl(g)+22H2O(g);ΔH=________。
(3) CeO2是汽车尾气净化催化剂中最重要的助剂,工作原理如图1所示。写出过程1发生反应的化学方程式:________________________________。

(4) 已知Ce(OH)4极易分解,用如图2所示装置电解CeCl3溶液在阴极区制得CeO2。电解过程中反应体系的pH随时间t的变化曲线如图3所示。
①电解进行1h内溶液的pH迅速下降,可能原因是________。
②请解释生成CeO2的原理:________。
(5) 常温下,当溶液中某离子浓度≤1.0×10-5时,可认为该离子沉淀完全。用Na2C2O4溶液对电解后的废液处理得到Ce2(C2O4)3固体,则应保持溶液中c(C2O42-)约为________。(已知25 ℃时,Ksp[Ce2(C2O4)3]=1.0×10-25)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com