
【题目】亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业,工业上生产亚氯酸钠和高氯酸的工艺流程如下:

已知:NaHSO4的溶解度随温度的升高而增大,适当条件下可结晶析出。请回答下列问题:
(1)NaClO2中氯元素的化合价为_________;某饱和NaCl溶液中含有CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是________。
(2)气体b是______(填化学式);无隔膜电解槽中阳极的电极反应式为___________。
(3)反应器I中发生反应的化学方程式为_________,冷却的目的是___________。
(4)反应器II中发生反应的离子方程式为________________。
(5)常温下,HClO2的电离平衡常数Ka=1.07×10-2,反应器II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中![]() =__________。
=__________。
【答案】 +3 ③②①⑤④(其他合理答案均可) H2 Cl--6e-+3H2O=ClO3-+6H+ 3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O 降低NaHSO4的溶解度,使NaHSO4结晶析出 2ClO2+ SO2+4OH-=2ClO2-+ SO42-+2H2O 1.07×1010
【解析】由工艺流程可知,在电解饱和食盐水时,阳极上溶液中的阴离子Cl-放电生成ClO3-,阴极上溶液中的阳离子H+放电生成H2.饱和食盐水经充分电解后得到氯酸钠溶液,在反应器I中,氯酸钠溶液经浓硫酸酸化发生了歧化反应,生成硫酸氢钠、二氧化氯和高氯酸。二氧化氯进入反应器II中被二氧化硫在碱性条件下还原得到亚氯酸钠。
(1). NaClO2中钠元素的化合价为+1价,氧元素的化合价为-2价,所以氯元素的化合价为+3;饱和NaCl溶液中含有CaCl2、MgCl2、Na2SO4等杂质,要制得纯净的食盐水,须除去钙离子、镁离子和硫酸根。除钙离子通常用碳酸钠溶液,除镁离子通常用氢氧化钠溶液,除硫酸根通常用氯化钡溶液,要想使杂质离子完全沉淀,所加除杂试剂必须过量一些,过量的氯化钡也得用碳酸钠溶液除去,所以碳酸钠溶液一定要在氯化钡溶液之后加入,待杂质离子完全沉淀后过滤,再向滤液中加入稀盐酸将过量的碳酸钠和氢氧化钠除去即完成了除杂。所以正确的操作顺序是③②①⑤④或 ③①②⑤④ 或②③①⑤④。
(2). 气体b是H2;无隔膜电解槽中阳极的电极反应式为Cl--6e-+3H2O=ClO3-+6H+ 。
(3). 反应器I中发生的反应是氯酸钠经浓硫酸酸化发生歧化反应生成HClO4、ClO2和3NaHSO4,化学方程式为3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O。因为NaHSO4的溶解度随温度的升高而增大,所以冷却的目的是降低NaHSO4的溶解度,使NaHSO4结晶析出。
(4).反应器II中发生的反应是二氧化氯被二氧化硫在碱性条件下还原得到亚氯酸钠,二氧化硫被氧化为硫酸根,离子方程式为2ClO2+ SO2+4OH-=2ClO2-+ SO42-+2H2O。
(5). )常温下,HClO2的电离平衡常数Ka=1.07×10-2,反应器II中反应所得NaClO2溶液中![]() =
=![]() =
=![]()
![]() =
= ![]()
![]()
![]() 1.07×10-2= 1.07×1010
1.07×10-2= 1.07×1010


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】一种新型金属氢化物镍电池(MH-Ni电池,MH为贮氢材料)工作原理如图所示。下列有关说法正确的是

A. 隔膜为阴离子交换膜
B. 电池的电解液可为硫酸
C. 充电时阳极反应为H2O+M+e-=MH+OH-
D. 放电时负极反应为Ni(OH)2+OH—-e-==NiOOH+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 金属钠与水反应:Na+ H2O=Na++ H2
B. 氯化铵溶液显酸性的原因:NH4++H2O=NH3·H2O+H+
C. AICl3溶液中加入足量氨水:Al3++4NH3-H2O= AlO2-+4NH4+2H2O
D. 氯化铁溶液中滴加少量的硫化氢溶液:2Fe3++H2S= 2Fe2++S+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料,可以制备一系列物质(如图)。下列有关表述正确的是( )
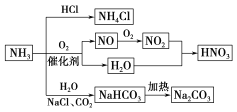
A. NH4Cl和NaHCO3都是常用的化肥
B. NH4Cl、HNO3和Na2CO3受热时都易分解
C. NH3和NO2在一定条件下可发生氧化还原反应
D. 图中所涉及产品均为离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作和现象对应的结论错误的是
选项 | 实验操作和现象 | 结论 |
A | 向溶液X中滴加BaCl2溶液,有白色沉淀生成 | 溶液X中可能含有SO42- |
B | 物质的量之比为2:3的稀硝酸和稀硫酸
| 反应结束后,锥形瓶中溶液的溶质是CuSO4,集气瓶中收集到的气体是NO |
C | 向1mL浓度均为0.05mol·L-1NaCl、NaI的混合溶液中滴加2滴0.01mol·L-1AgNO3溶液,振荡,沉淀是黄色 | Ksp(AgCl)<Ksp(AgI) |
D | 室温下,用pH试纸测得0.1mol·L-1 NaHSO3溶液的pH约为5 | HSO3-的电离程度大于其水解程度 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3—CH=CH—Cl,该有机物能发生①取代反应②加成反应③消去反应④使溴水褪色⑤使酸性KMnO4溶液褪色⑥与AgNO3溶液生成白色沉淀⑦聚合反应
A. 以上反应均可发生 B. 只有⑦不能发生
C. 只有⑥不能发生 D. 只有②不能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素/H2O2溶液可用于烟气的脱硫脱硝。
(1)已知T℃时,2SO2(g)+O2(g) ![]() 2SO3(g) △H1
2SO3(g) △H1
2H2O2(I)=2H2O(I)+O2(g) △H2
SO3(g)+H2O(I))=H2SO4(I) △H3
则SO2(g)+H2O2(I))=H2SO4(I) △H4=__________ (用含△H1、△H2、△H3的代数式表示)
(2)尿素[CO(NH2)2]溶液对NOx及SO2有一定的脱除率。将SO2和NOx (N〇约占90%)通入氧气的体积分数为7%、尿素浓度为5%的反应器中进行反应。
①烟气中SO2最终转化为一种正盐,其化学式为______________;NO和NO2以物质的量之比1:1与CO(NH2)2反应生成无毒气体的化学方程式为_______________。
②氨基甲酸铵(H2NCOONH4)是尿素的水解产物,将一定量的氨基甲酸铵置于恒容密闭容器中,发生反应:NH2COONH4(s)![]() 2NH3(g)+CO2(g) △H,实验测得不同温度下平衡时气体的总浓度如下表:
2NH3(g)+CO2(g) △H,实验测得不同温度下平衡时气体的总浓度如下表:
温度/K | 338 | 343 | 348 | 353 |
平衡时气体的总浓度/mol L-1 | 0.36 | 0.48 | 0.60 | 0.72 |
该反应的△H__________(填“>”或“<”)0;348K时,该反应的平衡常数K__________________。
(3)其他条件不变,向尿素溶液中添加H2O2溶液,测得不同 pH下氮氧化物的脱除率与时间的关系如图所示。
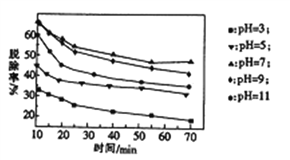
①NO与H2O2发生反应生成亚硝酸时,氧化剂与还原剂的物质的量之比为____________。
(2)脱硝时,最佳pH为_________;在碱性较强时,NOx脱除率降低,其原因是___________(任写一点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H3BO3可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是( )

A. M室发生的电极反应式为:2H2O-4e- = O2↑+4H+
B. N室中:a% <b%
C. b膜为阴膜,产品室发生反应的化学原理为强酸制弱酸
D. 理论上每生成1mol产品,阴极室可生成标准状况下5.6L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:
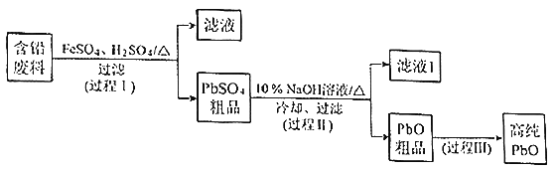
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是__________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++ PbO2+4H++SO42=2Fe3++PbSO4+2H2O
ii: ……
①写出ii的离子方程式:________________。
②下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.______________。
(3)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq),其溶解度曲线如图所示。
NaHPbO2(aq),其溶解度曲线如图所示。
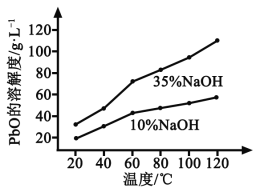
①过程Ⅱ的目的是脱硫。滤液1经处理后可在过程Ⅱ中重复使用,其目的是____._(选填序号)。
A.减少PbO的损失,提高产品的产率
B.重复利用氢氧化钠,提高原料的利用率
C.增加Na2SO4浓度,提高脱硫效率
②过滤Ⅲ的目的是提纯,综合上述溶解度曲线,简述过程Ⅲ的操作_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com