
【题目】H3BO3可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是( )

A. M室发生的电极反应式为:2H2O-4e- = O2↑+4H+
B. N室中:a% <b%
C. b膜为阴膜,产品室发生反应的化学原理为强酸制弱酸
D. 理论上每生成1mol产品,阴极室可生成标准状况下5.6L气体
 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】在稀硫酸和稀硝酸的混合溶液中,加入铜粉。
(1)若将50mL 4mol/L 稀HNO3和200mL 0.5mol/L稀H2SO4混合后,加入19.2g 铜粉,微热,充分反应。
①若忽略溶液体积变化,溶液中铜离子物质的量浓度为________mol/L。
②若使铜粉全部溶解,还需加入0.5mol/L H2SO4________________________mL。
(2)若c(SO42—)+c(NO3—)=a mol·L-1。取200 mL该混合酸,则能溶解铜的最大物质的量为___________mol(用含a的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业,工业上生产亚氯酸钠和高氯酸的工艺流程如下:

已知:NaHSO4的溶解度随温度的升高而增大,适当条件下可结晶析出。请回答下列问题:
(1)NaClO2中氯元素的化合价为_________;某饱和NaCl溶液中含有CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是________。
(2)气体b是______(填化学式);无隔膜电解槽中阳极的电极反应式为___________。
(3)反应器I中发生反应的化学方程式为_________,冷却的目的是___________。
(4)反应器II中发生反应的离子方程式为________________。
(5)常温下,HClO2的电离平衡常数Ka=1.07×10-2,反应器II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中![]() =__________。
=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol·L-1的NaOH溶液分别滴定体积均为50.00mL、浓度均为0.05mol·L-1的HClO、HF两种溶液,其滴定曲线如图所示。
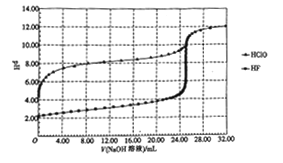
下列说法正确的是
A. HClO的酸性比HF强
B. V(NaOH溶液)=0 mL 时,对应溶液中:c(ClO-)=c(F-)
C. V(NaOH溶液)=12.50 mL 时,对应溶液中:c(ClO-)>c(F-)
D. V(NaOH溶液)=25.00mL时,对应溶液中:c(ClO-)<c(F-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1)NaClO2的化学名称为_______。
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103 mol·L1 。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________。增加压强,NO的转化率______(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______ (填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。

①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”、“不变”或“减小”)。
②反应ClO2+2SO32===2SO42+Cl的平衡常数K表达式为___________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______。
②已知下列反应:
SO2(g)+2OH (aq) ===SO32 (aq)+H2O(l) ΔH1
ClO (aq)+SO32 (aq) ===SO42 (aq)+Cl (aq) ΔH2
CaSO4(s) ===Ca2+(aq)+SO42(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO (aq) +2OH (aq) === CaSO4(s) +H2O(l) +Cl (aq)的ΔH=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg/L,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg/L。某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO。
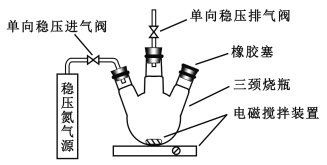
Ⅰ.测定原理:
碱性条件下,O2将Mn2+氧化为MnO(OH)2:①2Mn2++O2+4OH=2 MnO(OH)2↓
酸性条件下,MnO(OH)2将I氧化为I2:②MnO(OH)2+I+H+→Mn2++I2+H2O(未配平),用Na2S2O3标准溶液滴定生成的I2:③2S2O32+I2=S4O62+2I
Ⅱ. 测定步骤
a.安装装置,检验气密性,充N2排尽空气后,停止充N2。
b.向烧瓶中加入200 mL水样。
c.向烧瓶中依次迅速加入1 mL MnSO4无氧溶液(过量)、2mL碱性KI无氧溶液(过量),开启搅拌器,至反应①完全。
d搅拌并向烧瓶中加入2 mL硫酸无氧溶液至反应②完全,溶液为中性或弱酸性。
e.从烧瓶中取出40.00 mL溶液,以淀粉作指示剂,用0.01000 mol/L Na2S2O3溶液进行滴定,记录数据。
f.……
g.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化)。
回答下列问题:
(1)配置以上无氧溶液时,除去所用溶剂水中氧的简单操作为__________。
(2)在橡胶塞处加入水样及有关试剂应选择的仪器为__________。
①滴定管②注射器③量筒
(3)搅拌的作用是__________。
(4)配平反应②的方程式,其化学计量数依次为__________。
(5)步骤f为__________。
(6)步骤e中达到滴定终点的标志为__________。若某次滴定消耗Na2S2O3溶液4.50mL,水样的DO=__________mg/L(保留一位小数)。作为饮用水源,此次测得DO是否达标:__________(填“是”或“否”)
(7)步骤d中加入硫酸溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因(用离子方程式表示,至少写出2个)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示3套实验装置,分别回答下列问题。
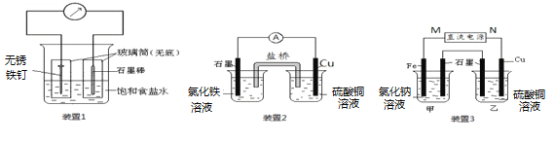
(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为_________________。
(2)装置2中的石墨是极________(填“正”或“负”),该装置发生的总反应的离子方程式为________________________。
(3)装置3中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞溶液,观察到石墨电极附近首先变红。
① 电源的M端为极____________(填“正”或“负”),甲烧杯中铁电极的电极反应为__________。
② 乙烧杯中电解反应的化学方程式为___________________________。
③ 停止电解,取出Cu电极,洗涤、干燥、称量、电极增重 0.64 g,甲烧杯中产生的气体标准状况下体积为___________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol·L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则x值为( )(要求写出解答过程)
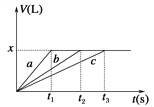
A. 1.12 B. 4.48
C. 2.24 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如下两个反应:(1)Cu+2Fe3+=Cu2++2Fe2+(2)Fe+Cu2+=Fe2++Cu。判断Fe3+、Fe2+、Cu2+氧化性强弱顺序排列正确的是
A. Fe3+>Cu2+>Fe2+
B. Cu2+>Fe3+>Fe2+
C. Fe3+Fe2+>Cu2+
D. Fe2+>Cu2+>Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com