
【题目】为了探究铁和硫反应产物中铁的化合价为+2价或+3价或既有+2也有+3价,某同学设计了如下图所示的实验过程:(已知硫会溶于热碱溶液)
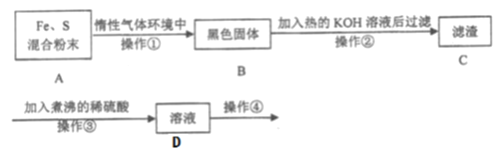
请回答以下问题:
(1)混合粉末A中S粉必须要过量,其原因是为了保证铁粉完全反应,从而避免_____。
(2)反应在“惰性气体环境中”进行的原因是______________________。
(3)操作①是用烧热的玻璃棒点触混合粉末,反应即可持续进行,这说明了_______。
(4)操作②的作用是________________________________________。
(5)操作③中稀硫酸煮沸的目的是____________________________________。
(6)为探究产物中铁的价态,需要继续对D溶液进行实验,请写出操作④的具体操作、现象及结论:__________________________________________。
【答案】 过量的铁粉与操作③中的反应生成Fe3+及过量的硫酸反应生成Fe2+而干扰实验验 防止Fe和S被氧化,尤其是Fe被氧化成Fe3O4而干扰实验 硫和铁粉反应是放热反应 除去混合物中过量的硫粉 防止硫酸中溶解的O2将前面反应过程中可能生成的Fe2+氧化而干扰实验 取少量的D溶液于两支小试管中,向第一支试管中滴加少量KSCN溶液,向第二支试管中滴加少量酸性高锰酸钾溶液.如果第一支试管出现血红色,而第二支试管高锰酸钾紫红色不褪去,说明铁和硫反应只生成三价铁;如果第一支试管不变血红色,而第二支试管高锰酸钾紫红色褪去,说明只生成亚铁;如果第一支试管变血红色,第二支试管紫红色也褪去,说明既生成了三价铁也生成了亚铁
【解析】试题分析:由实验过程可知,铁粉和硫粉在惰性气体中混合加热后,得到了黑色的固体。该固体中可能剩余的硫经热碱溶液溶解后,与稀硫酸反应得到溶液D,最后对D溶液进行检验,确定产物中铁元素的价态。
(1)混合粉末A中S粉必须要过量,其原因是为了保证铁粉完全反应,从而避免过量的铁粉与操作③可能生成的Fe3+及硫酸反应生成Fe2+而干扰实验验。
(2)反应在“惰性气体环境中”进行的原因是防止Fe和S被氧化,尤其是Fe被氧化成Fe3O4而干扰实验。
(3)操作①是用烧热的玻璃棒点触混合粉末,反应即可持续进行,这说明了硫和铁粉反应是放热反应。
(4)操作②的作用是除去混合物中过量的硫粉。
(5)操作③中稀硫酸煮沸的目的是防止硫酸中溶解的O2将前面反应过程中可能生成的Fe2+氧化而干扰实验。
(6)为探究产物中铁的价态,需要继续对D溶液进行实验,操作④的具体操作、现象及结论为:取少量的D溶液于两支小试管中,向第一支试管中滴加少量KSCN溶液,向第二支试管中滴加少量酸性高锰酸钾溶液.如果第一支试管出现血红色,而第二支试管高锰酸钾紫红色不褪去,说明铁和硫反应只生成三价铁;如果第一支试管不变血红色,而第二支试管高锰酸钾紫红色褪去,说明只生成亚铁;如果第一支试管变血红色,第二支试管紫红色也褪去,说明既生成了三价铁也生成了亚铁。


科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g) ![]() CO(g)+3H2(g)。 设起始
CO(g)+3H2(g)。 设起始![]() ,在恒压下,平衡时CH4的体积分数
,在恒压下,平衡时CH4的体积分数![]() 与Z和T(温度)的关系如图所示,下列说法错误的是
与Z和T(温度)的关系如图所示,下列说法错误的是
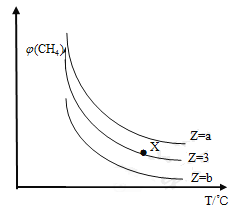
A. 该反应的焓变△H>0
B. 图中Z的大小为b>3>a
C. 图中X点对应的平衡混合物中![]()
D. 温度不变时,加压,平衡逆向移动,甲烷的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将11.2g铁投入200mL某浓度的盐酸中,铁和盐酸恰好完全反应.求:
(1)11.2g铁的物质的量
(2)所用盐酸中HCl的物质的量浓度
(3)反应中生成的H2在标准状况下的体积.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗盐中含有Ca2+、Mg2+及SO ![]() ,除去杂质离子所加入的试剂及顺序可以是:试剂①NaOH、试剂②、试剂③、试剂④ . 在加试剂③后,应先进行一个实验操作之后再加入试剂④.
,除去杂质离子所加入的试剂及顺序可以是:试剂①NaOH、试剂②、试剂③、试剂④ . 在加试剂③后,应先进行一个实验操作之后再加入试剂④.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质应用的说法错误的是
A.SO2可用作食品添加剂B.CCl4 可用于鉴别溴水和碘水
C.浓氨水可用来清洗试管壁的银镜D.Na2S 可除去污水中的 Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应逆反应的△H_____0(填“<”“>”“=”)。
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003mol·L-1·s-1。则6s时c(A)=_____________,C的物质的量为_____________;若反应经一段时间后,达到平衡时A的转化率为_______________,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为 ___________________。
(3)1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为____________。
A(g)+B(g)的平衡常数的值为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表为元素周期表的一部分.
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为__.
(2)表中元素原子半径最大的是(写元素符号)__.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__.
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1mol Y 单质比1mol S 得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1mol X 的最高价化合物,恢复至室温,放热687kJ.已知该化合物的熔沸点分别为﹣69℃和58℃,写出该反应的热化学方程式:__.
(5)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中的两种元素组成,气体的相对分子质量都小于50.为防止污染,将生成的气体完全转化为最高价含氧酸盐,消耗1L 2.2mol/L NaOH 溶液和1mol O2,则两种气体的分子式分别为__,物质的量分别为__,生成硫酸铜物质的量为__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A.用金属钠可区分乙醇和乙醚B.用高锰酸钾酸性溶液可区分己烷和3-己烯
C.用水可区分乙醇、甲苯、硝基苯D.用新制的银氨溶液可区分甲酸甲酯和乙醛
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com