
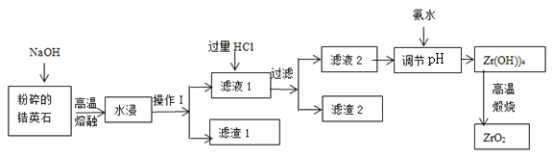
【题目】氧化锆(ZrO2)材料具有高硬度、高熔点、高强度、高韧性、极高的耐磨性及耐化学腐蚀性等优良的物化性能。以锆英石(主要成分为 ZrSiO4,含有少量Al2O3、SiO2、Fe2O3等杂质)为原料通过碱熔法制备氧化锆(ZrO2)的流程如下:
25℃时,有关离子在水溶液中沉淀时的pH数据:
Fe(OH)3 | Zr(OH)4 | Al(OH)3 | |
开始沉淀时pH | 1.9 | 2.2 | 3.4 |
沉淀完全时pH | 3.2 | 3.2 | 4.7 |
请回答下列问题:
(1)流程中旨在提高化学反应速率的措施有________________________________。
(2)操作I的名称是__________________,滤渣1成分为_________,滤渣2的成分为_____________。
(3)锆英石经“高温熔融”转化为Na2ZrO3,写出该反应的化学方程式:____________________。
(4)“调节pH”时,合适的pH范围是__________________。为了得到纯的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是__________________。
(5)写出“高温煅烧”过程的化学方程式________________________________。根据ZrO2的性质,推测其一种用途________________________________。
【答案】粉碎、高温 过滤 Fe2O3 H2SiO3 4NaOH+ZrSiO4![]() Na2ZrO3+Na2SiO3+2H2O 3.2~3.4 取最后一次洗涤液加入硝酸银溶液和稀硝酸,没有白色沉淀证明洗涤干净 Zr(OH)4
Na2ZrO3+Na2SiO3+2H2O 3.2~3.4 取最后一次洗涤液加入硝酸银溶液和稀硝酸,没有白色沉淀证明洗涤干净 Zr(OH)4![]() ZrO2+2H2O 耐火材料、坩埚、打磨材料牙齿材料等
ZrO2+2H2O 耐火材料、坩埚、打磨材料牙齿材料等
【解析】
锆英砂(主要成分为ZrSiO4,还含少量Fe2O3、Al2O3、SiO2等杂质)加NaOH熔融,二氧化硅反应转化为硅酸钠,ZrSiO4转化为Na2SiO3和Na2ZrO3,氧化铝和氢氧化钠反应生成偏铝酸钠,水浸过滤,滤渣1为Fe2O3,得到滤液1中加过量盐酸酸浸,Na2SiO3与HCl生成硅酸沉淀,偏铝酸钠和过量盐酸反应得到氯化铝,滤渣2为H2SiO3,滤液中含有ZrO2+、Al3+,加氨水调节pH为3.2~3.4使ZrO2+转化为Zr(OH)4沉淀,过滤、洗涤,得到Zr(OH)4,加热分解,即可得到ZrO2。
(1)流程中旨在提高化学反应速率的措施有粉碎固体,升高温度。
(2)操作Ⅰ用于分离固体和液体,操作I的名称是过滤,滤渣1成分为Fe2O3,滤渣2的成分为H2SiO3。
(3)锆英石经“高温熔融”转化为Na2ZrO3,高温下,ZrSiO4与NaOH反应生成Na2SiO3和Na2ZrO3,该反应的化学方程式:4NaOH+ZrSiO4![]() Na2ZrO3+Na2SiO3+2H2O。
Na2ZrO3+Na2SiO3+2H2O。
(4)“调节pH”时,合适的pH范围是3.2~3.4使ZrO2+完全转化为Zr(OH)4沉淀,且避免生成Al(OH)3;Zr(OH)4表面为附着Cl-等,为了得到纯的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是:取最后一次洗涤液,向其中滴加稀硝酸,再滴加硝酸银溶液,若无沉淀生成,则Zr(OH)4洗涤干净。
(5)“高温煅烧”过程的化学方程式Zr(OH)4![]() ZrO2+2H2O。根据ZrO2的性质,推测其一种用途,推测其两种用途有耐火材料、磨料等。
ZrO2+2H2O。根据ZrO2的性质,推测其一种用途,推测其两种用途有耐火材料、磨料等。


科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 四种元素原子的核电荷数依次增大,它们的简单离子的电子层数相同且最外层电子数均为8,
四种元素原子的核电荷数依次增大,它们的简单离子的电子层数相同且最外层电子数均为8,![]() 元素原子的
元素原子的![]() 层电子数与
层电子数与![]() 、
、![]() 层电子数之和相等,
层电子数之和相等,![]() 元素原子的
元素原子的![]() 、
、![]() 层电子数之和等于电子总数的一半。试回答下列问题。
层电子数之和等于电子总数的一半。试回答下列问题。
(1)四种元素的符号依次是![]() ______,
______,![]() ______,
______,![]() ______,
______,![]() ______;它们的原子半径由大到小的顺序是______(用元素符号表示)。
______;它们的原子半径由大到小的顺序是______(用元素符号表示)。
(2)试写出四种元素的离子结构示意图:![]() ______,
______,![]() ______,
______,![]() ______,
______,![]() ______。它们的离子半径由大到小的顺序是______(用离子符号表示)。
______。它们的离子半径由大到小的顺序是______(用离子符号表示)。
(3)分别写出四种元素的最高价氧化物对应水化物的化学式:______。
(4)分别写出![]() 、
、![]() 两元素的气态氢化物的化学式:______。
两元素的气态氢化物的化学式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
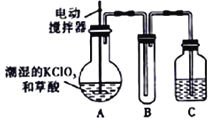
【题目】实验室可通过反应:3Cl2+6KOH![]() 5KCl+KC1O3+3H2O 制取KC1O3,再用稍潮湿KC1O3和草酸(H2C2O4) 在60℃时反应制取ClO2气体,装置如图所示。ClO2是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。
5KCl+KC1O3+3H2O 制取KC1O3,再用稍潮湿KC1O3和草酸(H2C2O4) 在60℃时反应制取ClO2气体,装置如图所示。ClO2是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。
请回答下列问题:
(1)A 中反应的主要产物有:某种正盐、ClO2和CO2等,写出该反应的化学方程式:_____。
(2)请分析装置图,进行补充和完善。A部分缺________装置,B部分还应补充_______装置,还有一处设计明显不合理的是___________(填“A”“B”或“C”)。
(3)C中的试剂为NaOH溶液时,反应生成NaClO3和NaClO2,写出该反应的离子方程式____。
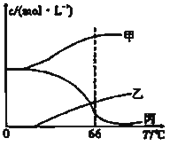
(4)在密闭容器中向9℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是______;继续通入适量Cl2,将溶液加热,溶液中主要离子的浓度随温度的变化如图所示,图中甲、乙、丙依次表示的离子是__________、__________、__________(不考虑Cl2的挥发)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如图所示,下列说法正确的
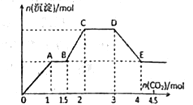
A. CD段的离子方程式可以表示为:CO32-+CO2+H2O═2HCO3-
B. 肯定不存在的离子是SO42-、OH-
C. 该溶液中能确定存在的离子是Ba2+、AlO2-、NH4+
D. OA段反应的离子方程式:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)2SO3(g)反应过程中的能量变化如图所示。已知1 mol SO2(g)被氧化为1 mol SO3(g)的ΔH1=-99 kJ/mol。请回答下列问题:
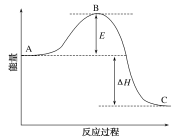
(1)图中A、C分别表示_____、____,E的大小对该反应的反应热有无影响?____(填“有”或“无”)。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?____,理由是_________。
(2)图中ΔH=____kJ/mol。
(3)如果反应速率v(SO2)为0.05 mol·L-1·min-1,则v(O2)=____ mol·L-1·min-1,v(SO3)=___mol·L-1·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A. 能使pH试纸显蓝色的溶液中:Na+、ClO-、Fe3+、SO42-
B. 含有大量Al3+的溶液中:K+、Mg2+、NO3-、HCO3-
C. ![]() =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
D. 常温下由水电离出的c(H+)=10-13 mol·L-1的溶液中:Na+、Ba2+、HCO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.将1mol氯化铁完全溶于水制成胶体,其中所含胶体粒子数目小于NA
B.标准状况下22.4 L HF中含有的氟原子数目为NA
C.常温下,2.8g C2H4与C3H6的混合物中共价键数为0.6NA
D.1L含NA个Al3+的Al(NO3)3液中,NO3-物质的量浓度大于3 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某微生物电解池(MEC)制氢工作原理如右图所示。用该电解池电解0.1mol·L-1的CH3COOH溶液,下列说法正确的是
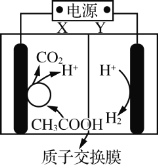
A.Y为电源的正极
B.该电解装置中,阳极的电极反应式为:CH3COOH+2H2O+8e-= 2CO2↑+8H+
C.当2mol H+通过质子交换膜时,则标准状况下产生22.4L H2
D.电解一段时间后,溶液中![]() 的值变小
的值变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图涉及的物质所含元素中,除一种元素外,其余均为1~18号元素。

已知:A、F为无色气体单质,B为具有刺激性气味的气体,化学家哈伯因合成B获得1918年的诺贝尔化学奖。C为黑色氧化物,E为紫红色金属单质,I为蓝色沉淀(部分反应的产物未列出)。请回答下列问题:
(1)常温下铝遇到G的浓溶液后表面形成一层致密的保护膜,该现象称为___________。
(2)E与G的稀溶液反应的离子方程式为_________。
(3)在25 ℃和101 kPa的条件下,将VL的B气体溶于100 mL水中,得到密度为ρg·mL-1的溶液M,则M溶液的物质的量浓度为________ mol·L-1。(已知25 ℃、101 kPa条件下气体摩尔体积为24.5 L·mol-1,不必化简)
(4)分别蘸取B的浓溶液和G的浓溶液的玻璃棒,接近后的现象是_________。
(5)B和C反应的化学方程式为__________。
(6)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com