
| A、蓄电池放电时,每消耗0.1molPb,共生成0.1molPbSO4 |
| B、电解池的阴极反应式为:2H++2e-=H2↑ |
| C、电解过程中溶液中会产生白色沉淀现象 |
| D、蓄电池中每生成1molH2O,电解池中就消耗1molH2O |


科目:高中化学 来源: 题型:
 短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素.
短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素.查看答案和解析>>
科目:高中化学 来源: 题型:

- 4 |
- 2 |
 ═□Mn2++□NO
═□Mn2++□NO- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向盐酸中滴加氨水的过程,可能满足c(H+)>c(NH4+) |
| B、0.1mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| C、等浓度的NaClO、NaHCO3混合溶液中:c(Na+)=c(ClO?)+c(HClO)+c(HCO3-)+c(H2CO3)+c(CO32-) |
| D、浓度均为0.1mol/L的HA(一元弱酸)和NaA溶液等体积混合后,若溶液呈酸性,则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定含有I-,不含有Cl- |
| B、可能含有Cl-、NO3-和I- |
| C、可能含有NO3- |
| D、一定不含有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
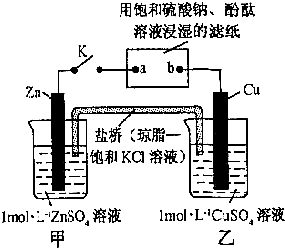
| A、Cu电极上发生还原反应 |
| B、电子沿Zn→a→b→Cu路径流动 |
| C、片刻后盐桥中Cl-向左移动 |
| D、片刻后可观察到滤纸a点变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨气通入醋酸溶液中:NH3+H+=NH4+ | ||||
B、用铜片作阴、阳极电解硝酸银溶液:4Ag++2H2O
| ||||
| C、碳酸氢钡溶液中加入过量氢氧化钠溶液:Ba2++HCO3-═BaCO3↓+H2O | ||||
| D、AgCl沉淀在氨水中溶解:AgCl+2NH3?H2O══[Ag(NH3)2]++Cl-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaOCl2 |
| B、(NH4)2Fe(SO4)2 |
| C、BiONO3 |
| D、K3[Fe(CN)6] |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图1表示同温度下,Ph=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 |
| B、向溶质为1mol的NaOH溶液中通入CO2,随着CO2气体的通入,溶液中水电离出的c(H+)有如上图2变化关系 |
| C、如图2所示,水电离出c(H+)达到最大值时,溶液中各离子浓度大小分别为:c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)>c(H+) |
| D、用0.0100mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/L Cl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com