
【题目】一定温度下,对可逆反应3A(g) ![]() 2B(g) +C(g)的下列叙述中,能说明反应已达到平衡的是( )
2B(g) +C(g)的下列叙述中,能说明反应已达到平衡的是( )
A.C生成的速率与B分解的速率相等
B.单位时间内消耗3a mol A, 同时消耗生成a mol C
C.容器内的压强不再变化
D.混合气体的物质的量不再变化
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】已知:①H2(g)+ ![]() O2(g)=H2O(g);ΔH1= akJ·mol-1
O2(g)=H2O(g);ΔH1= akJ·mol-1
②2H2(g)+O2(g) = 2H2O(g);ΔH2= b kJ·mol-1 ③ H2(g)+ ![]() O2(g)=H2O(l);ΔH3= c kJ·mol-1
O2(g)=H2O(l);ΔH3= c kJ·mol-1
④2H2(g)+O2(g) = 2H2O(l);ΔH4= d kJ·mol-1 , 下列关系式中正确的是( )
A.2a=b<0
B.b>d>0
C.a<c<0 D 2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化:

(1)化合物D中官能团的名称为_______;反应②中Cu的作用是__________。反应①.④的反应类型分别为_______、________。
(2)分别写出反应①、③、④的化学方程式。
①_____________。
③_____________。
④_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2A(g) + B(g) ![]() C(g) + 3D(g),达到平衡时,下列说法正确的是( )
C(g) + 3D(g),达到平衡时,下列说法正确的是( )
A. A、B全部变成了C和D
B. A、B、C、D四种物质的浓度一定相等
C. 反应速率为零
D. 单位时间内B消耗的物质的量和B生成的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各说法中,正确的是( )
A.对于2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-Q kJ·mol-1 , (Q>0),若反应中充入1mol SO2和足量的氧气反应时,放出的热量一定是Q/2 kJ
2SO3(g) ΔH=-Q kJ·mol-1 , (Q>0),若反应中充入1mol SO2和足量的氧气反应时,放出的热量一定是Q/2 kJ
B.热化学方程式中的化学计量数不能用分数表示
C.Zn(s)+H2SO4(aq) =ZnSO4(aq)+H2(g) ΔH<0,该反应的化学能可以转化为电能
D.ΔH的大小与热化学方程式的化学计量数无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2是大气的主要污染物之一,某研究小组设计如图所示的装置对NO2进行回收利用,装置中a、b均为多孔石墨电极。下列说法不正确的是
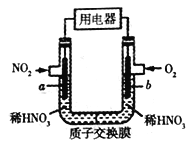
A. a为电池的负极,发生氧化反应
B. 一段时间后,b极附近HNO3 浓度减小
C. 电池总反应为4NO2+O2+2H2O![]() 4HNO3
4HNO3
D. 电子流向:a电极→用电器→b电极→溶液→a电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH 溶液,分别滴定等体积且浓度均为0.1mol/L的三种酸(HA、HB 和HD)溶液,滴定的曲线如图所示,下列判断正确的是

A. 三种酸的电离常数关系:K(HD)>K(HB)>K(HA)
B. pH=7 时,三种溶液中:c(A-)=c(B-)=c(D-)
C. 当三种酸中和百分数达100%时,离子总浓度最大的是NaD 溶液
D. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。电解铝时阳极产生的CO2可通过二氧化碳甲烷化等再利用。请回答:
(1)已知:①.2Al2O3(s)=4Al(g)+3O2(g) △H1=+3351kJ/mol
②. 2C(s)+ O2(g)=2CO(g) △H2=-221kJ/mol
③. 2Al(g)+ N2(g)=2AlN(s) △H3=a kJ/mol
④. Al2O3(s)+ 3C(s)+ N2(g)=2AlN(s)+3CO(g) △H4=+1026kJ/mol
反应③的a=______,反应④自发进行的条件是______(填“高温”、“低温”或“任意温度”)
(2)在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1:4,总物质的量x mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应ⅠCO2(g)+4H2(g)![]() CH4(g)+2H2O(g)△H4
CH4(g)+2H2O(g)△H4
反应ⅡCO2(g)+H2(g)![]() CO(g)+H2O(g)△H5
CO(g)+H2O(g)△H5
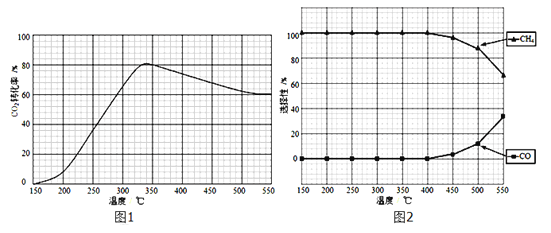
①下列说法正确的是___________。
A.△H5 小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1:3,可提高CO2平衡转化率
②350℃时,反应I在t1时刻达到平衡,平衡时容器体积为yL,该温度下反应I的平衡常数为____(用x、y 表示)。
(3)CO2溶于水形成H2CO3。已知常温下H2CO3 的电离平衡常数K1=4.4×10-7,K2=4.7×10-11,NH3·H2O的电离平衡常数Kb=1.75×10-5。常温下,用氨水吸收CO2 可得到NH4HCO3 溶液,NH4HCO3 溶液显______(填“ 酸 性”、“ 中性” 或“ 碱性”);请计算反应NH4++HCO3-+ H2O![]() NH3·H2O+H2CO3 的平衡常数K=_____________。
NH3·H2O+H2CO3 的平衡常数K=_____________。
(4)据文献报道,二氧化碳可以在酸性水溶液中用情性电极电解得到乙烯,其原理如图所示。
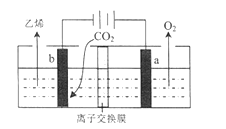
b电极上的电极反应式为____________________________,该装置中使用的是________(“ 阴”或“ 阳”) 离子交换膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体区别于其他分散系的本质特征是( )
A.分散质粒子能作不停的、无规则的运动
B.光线透过时能观察到光亮的通路
C.静置后既不分层,也无沉淀产生
D.分散质粒子直径在10-9~10-7 m之间
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com