
【题目】下图为探究铝片和![]() 溶液反应的实验方案及现象。下列说法错误的是( )
溶液反应的实验方案及现象。下列说法错误的是( )
|
| |
无明显现象 | 铝片表面产生细小气泡 | 出现白色浑浊,产生大量气泡(经检验为 |
A.![]() 溶液显碱性的原因:
溶液显碱性的原因:![]()
B.加热和![]() 逸出对
逸出对![]() 水解平衡移动方向的影响是相反的
水解平衡移动方向的影响是相反的
C.对比实验I、Ⅲ,说明![]() 溶液能破坏铝表面的氧化膜
溶液能破坏铝表面的氧化膜
D.推测出现的白色沉淀可能是氢氧化铝
【答案】B
【解析】
铝的化学性质活泼,因此铝片表面常常会附着致密的氧化物薄膜,这层薄膜会对内部的Al单质起到一定的保护作用;碳酸钠溶液显碱性主要因为碳酸根的水解,氧化铝是两性氧化物,因此铝片表面的氧化铝可以在碳酸钠溶液中溶解,进而碳酸钠溶液可以与内部的Al单质反应;由于Al单质与碳酸钠的反应,实质是Al在消耗碳酸根水解产生的OH-,这会导致碳酸根的水解平衡正向移动,进而产生氢气以及CO2气体。
A.碳酸根是多元弱酸的酸根离子,分步水解以第一步水解为主,因此碳酸钠溶液显碱性的原因为:![]() ,A项正确;
,A项正确;
B.盐类水解为吸热过程,加热可促进盐类的水解;氢气的逸出有利于铝和OH-的反应,OH-被消耗也会促进碳酸根离子的水解,所以加热和氢气逸出都会对![]() 的水解平衡起到促进作用,B项错误;
的水解平衡起到促进作用,B项错误;
C.实验Ⅲ中产生了气泡,说明Al单质发生了反应;Al单质由于性质活泼,表面往往会生成致密的氧化铝薄膜,从而使得内部的Al单质被保护;因此由现象可说明实验Ⅲ中铝片表面的氧化铝被碳酸钠溶液破坏掉了,C项正确;
D.碳酸钠溶液与Al单质反应,可将其转化为![]() ;由于碳酸根水解平衡被促进,导致溶液中含有较多的
;由于碳酸根水解平衡被促进,导致溶液中含有较多的![]() ,其可与
,其可与![]() 反应生成Al(OH)3白色沉淀,D项正确;
反应生成Al(OH)3白色沉淀,D项正确;
答案选B。


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】下列关于自然界中氮循环(如图)的说法不正确的是:

A. 氮元素均被氧化
B. 工业合成氨属于人工固氮
C. 含氮无机物和含氮有机物可相互转化
D. 碳、氢、氧三种元素也参与了氮循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组在研究前18号元素时发现:依据不同的标准和规律,元素周期表有不同的排列形式。如果将它们按原子序数递增的顺序排列,可形成如图所示的“蜗牛”形状,图中每个“”代表一种元素,其中P点代表氢元素。下列说法不正确的是( )
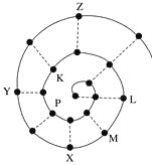
A. 图中虚线相连的元素位于同一族
B. P、K、L、M、X、Y、Z都是短周期元素
C. K元素位于常规周期表的第三周期第ⅥA族
D. M与Z 两种元素形成的化合物的化学式为MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用软锰矿及含锰废料(主要成分![]() ,含有少量
,含有少量![]() 等)与烟气脱硫进行联合处理并制备
等)与烟气脱硫进行联合处理并制备![]() 的流程如下:
的流程如下:
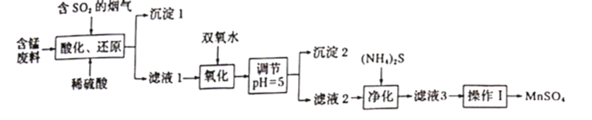
25℃时,几种金属离子沉淀时的pH如下:
|
|
|
|
| |
开始沉淀时pH | 7.6 | 2.7 | 3.8 | 8.3 | 5.9 |
完全沉淀时pH | 9.7 | 4.0 | 4.7 | 9.8 | 6.9 |
(1)![]() 在酸化还原步骤中所发生反应的离子方程式分别为_____________、_____________。
在酸化还原步骤中所发生反应的离子方程式分别为_____________、_____________。
(2)沉淀1为_________(填化学式),用双氧水处理滤液1时,通常在40~55℃下进行原因是_____________。
(3)氧化反应过程中常会有一定量的气泡产生,可能的原因是___________,调节溶液![]() 的目的是_______________
的目的是_______________
(4)“净化”时,加入![]() 的作用是______________
的作用是______________
(5)滤液3中除![]() 外,还含有少量
外,还含有少量![]() 。
。![]() 的溶解度曲线如图所示。据此判断,“操作I”应为___________、______、洗涤、干燥。
的溶解度曲线如图所示。据此判断,“操作I”应为___________、______、洗涤、干燥。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取Cl2的反应:
4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O。下列说法不正确的是( )
MnCl2+Cl2↑+2H2O。下列说法不正确的是( )
A.氧化剂是MnO2,还原剂是HCl
B.每生成1 mol Cl2,转移电子的物质的量是2 mol
C.每消耗1 mol MnO2,表现还原作用的HCl为4 mol
D.Cl2是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用化合物A模拟工业上制备含氧酸D的过程如图所示,已知D为强酸,请回答下列问题。
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是________;
②在工业生产中,B气体的大量排放被雨水吸收后形成了_____而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体。
①A的化学式是_________;C的化学式是_______。
②D的浓溶液在常温下可与铜反应并生成C气体,反应的化学方程式是____,该反应______(填“属于”或“不属于”)氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化碳和氢气是重要的化工原料,常用于合成甲醇、二甲醚、甲酸甲酯等有机物。
(1)已知![]() 的燃烧热分别是
的燃烧热分别是![]() ,则甲醇与一氧化碳催化合成乙酸的热化学方程式为_____________。
,则甲醇与一氧化碳催化合成乙酸的热化学方程式为_____________。
(2)有人设想将![]() 按下列反应除去
按下列反应除去![]() ,该反应能否自发进行______________(填“是”或“否”),依据是_____________。
,该反应能否自发进行______________(填“是”或“否”),依据是_____________。
(3)向体积可变的密闭容器中投入![]() 和
和![]() ,在不同条件下发生反应:
,在不同条件下发生反应:![]() 。测得
。测得![]() 的平衡转化率随温度、压强的变化如图所示。
的平衡转化率随温度、压强的变化如图所示。
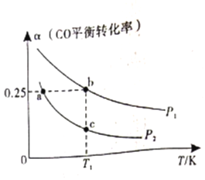
①该可逆反应的![]() __________0(填>”、“<”或“=”)。a、b、c三点对应的平衡常数
__________0(填>”、“<”或“=”)。a、b、c三点对应的平衡常数![]() 的大小关系是____________________。
的大小关系是____________________。
②在恒温恒容条件下进行该反应,能表示反应达到平衡状态的是______________(填字母)。
a. CO的体积分数保持不变
b. 容器内混合气体的密度保持不变
c.容器内混合气体的平均摩尔质量保持不变
d.单位时间内消耗CO的浓度等于生成![]() 的浓度
的浓度
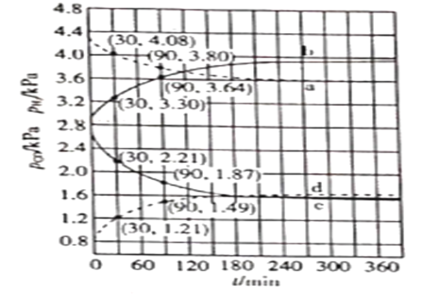
(4)在催化剂作用下,![]() 时分别进行反应:
时分别进行反应:![]() ,
,![]() ,测得CO和
,测得CO和![]() 的分压随时间的变化关系如图所示。起始时,体系中
的分压随时间的变化关系如图所示。起始时,体系中![]() 和
和![]() 相等、
相等、![]() 和
和![]() 相等。计算曲线a的反应在
相等。计算曲线a的反应在![]() 内的平均速率
内的平均速率![]() _______
_______![]() 。
。![]() 时
时![]() 随时间变化关系的曲线是_______,
随时间变化关系的曲线是_______,![]() 时
时![]() 随时间变化关系的曲线是___________。
随时间变化关系的曲线是___________。
(5)一定条件下,![]() 与粉末状氢氧化钠反应生成甲酸钠。已知:常温时,甲酸的电离平衡常数
与粉末状氢氧化钠反应生成甲酸钠。已知:常温时,甲酸的电离平衡常数![]() 。向
。向![]() 的甲酸钠溶液中加入
的甲酸钠溶液中加入![]() 的盐酸,混合液呈__________性(填“酸”或“碱”),溶液中离子浓度从大到小的顺序为__________________。
的盐酸,混合液呈__________性(填“酸”或“碱”),溶液中离子浓度从大到小的顺序为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型电池的工作原理如图所示。该电池工作时,下列说法错误的是
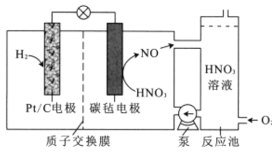
A.Pt/C电极为负极,质子通过交换膜从负极区移向正极区
B.正极的电极反应为NO3-+4H+3e-=NO↑+2H2O
C.反应池中发生总反应4NO+3O2+2H2O=4HNO3,实现HNO3再生
D.理论上,当消耗22.4L(标准状况下)H2时,会消耗1molO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全世界每年因生锈损失的钢铁,约占世界年产量的十分之一。一种钢铁锈蚀原理示意图如右,下列说法不正确的是

A. 缺氧区:Fe-2e-=== Fe2+
B. 富氧区:O2 + 2H2O + 4e-=== 4OH-
C. Fe失去的电子通过电解质溶液传递给O2
D. 隔绝氧气或电解质溶液均可有效防止铁生锈
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com