
Ⅰ(5分)某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如右图所示。
(1)由图中所给数据进行分析,该反应的化学方程式为___________________________________;
(2)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=__________________。
Ⅱ(7分)将2mol H2O和2mol CO置于1L容器中,加热至高温,发生如下可逆反应:
2H2O(g)  2H2(g)+O2(g),2CO(g)+O2(g)
2H2(g)+O2(g),2CO(g)+O2(g)  2CO2(g)。
2CO2(g)。
(3)当上述系统达到平衡时,欲求混合气体的平衡组成,至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是________和________,或________和________(填分子式)。
(4)若平衡时O2和CO2的物质的量分别为a mol和b mol,则平衡时H2O的物质的量为_______________________ (用含a、b的代数式表示)
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:
根据表1信息,判断以下叙述正确的是( )
表1 部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
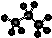 A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速率为L<Q
A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
在冶金工业上,通常均不能用化学还原剂制得的金属组是( )
A.Na、Ba、Mg、A1 B.Zn、Fe、Cu、Ag
C.Na、K、Zn、Fe D.Mg、Al、Zn、Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
某原电池总反应的离子方程式为2Fe3++Fe=3Fe2+,能实现该反应的原电池组成是( )
A.正极为铁,负极为铜,电解质溶液为FeCl3溶液
B.正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液
C.正极为铁,负极为锌,电解质溶液为Fe2(SO4)3溶液
D.正极为银,负极为铁,电解质溶液为CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
大气污染问题已成影响环境的重要因素,有人想利用下列反应:
2CO(g)+SO2(g) 2CO2 (g) +S (g) ΔH= +8.0 kJ·mol-1来减少污染,使用新型催化剂加快反应。下列有关该反应过程的能量变化示意图正确的是
2CO2 (g) +S (g) ΔH= +8.0 kJ·mol-1来减少污染,使用新型催化剂加快反应。下列有关该反应过程的能量变化示意图正确的是
查看答案和解析>>
科目:高中化学 来源: 题型:
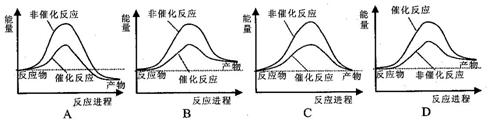
在一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g) 2C(g) △H<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是
2C(g) △H<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是
A. 0~t2时,v(正)>v(逆)
B. t2时刻改变的条件可能是加催化剂
C.Ⅰ、Ⅱ两过程达到反应限度时,A的体积分数Ⅰ=Ⅱ
D.Ⅰ、Ⅱ两过程达到反应限度时,平衡常数I<Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)煤的气化的主要化学反应方程式为: 。
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) 
 CH3OH(g) ΔH=-90.8kJ·mol-1
CH3OH(g) ΔH=-90.8kJ·mol-1
②2CH3OH(g) 
 CH3OCH3(g)+H2O(g) ΔH=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-23.5kJ·mol-1
③CO(g)+H2O(g) 
 CO2(g)+H2(g) ΔH=-41.3kJ·mol-1
CO2(g)+H2(g) ΔH=-41.3kJ·mol-1
写出水煤气直接合成二甲醚同时生成CO2的热化学反应方程式 。
(3)一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 。
a.高温高压 b.低温低压 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚 f.加入催化剂
(4)已知反应②2CH3OH(g) 
 CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
比较此时正、逆反应速率的大小:v(正) v(逆)(填“>”、“<”或“=”),若上述情况达到平衡,此时c(CH3OH)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法合理的是 ( )
A.在稀硫酸中加入铜粉,铜粉不溶解;再加入K NO3 固体,铜粉仍不溶解
B.将等物质的量Cl2与SO2通入品红溶液,漂白性增强
C.浓H2SO4与Cu或C反应都需加热,浓硝酸与Cu或C反应都不需加热
D.铝、氧化铝、小苏打、醋酸铵都既能与盐酸又能与氢氧化钠溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com