
【题目】
主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子效的3倍。X、Y和Z分属不同的周期,它们的原子序教之和是W 原子序数的5倍。在由元素W、X、Y、Z组成的所有可能的二元化合物中.由元素W与Y形成的化合物M的熔点最高。
请回答下列问题:
(1)W元素原子的L层电子排布式为__________,W3分子的空间构型为______;
(2)X单质与水发生主要反应的化学方程式为_____________;
(3)化合物M的化学式为_______,其晶体结构与NaCl相同,而熔点高于NaCl。M熔点较高的原因是_________。将一定量的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中,碳原子采用的杂化方式有___________,O-C-O的键角约为_______;
(4)X、Y、Z可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角,Z处于体心位置,则该晶体的组成为X:Y:Z=___________;
(5)含有元素Z的盐的焰色反应为_____色。许多金属盐都可以发生焰色反应,其原因是_________。
【答案】2s22p4V形(或角形)2F2 +2H2O =4 HF+ O2MgO电荷大,半径小,(或晶格能大)sp3和sp2120°3:1:1淡紫激发态电子从能量高的轨道跃迁到回到能量低的轨道时,以一定波长(可见光区域)光的形式释放能量
【解析】
分析:主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍,则W有3个电子层,最外层电子数为6,故W为氧元素;X,Y,Z分属不同的周期,且主族元素W、X、Y、Z的原子序数依次增大.X不可能为第三周期元素,若为第三周期,X、Y、Z的原子序数之和大于W原子序数的5倍,所以可以断定X在第二周期,且原子序数比氧元素大,故X为F元素;故Y、Z的原子序数之和为8×5-9=31,平均原子序数为15.5,故Y处于第三周期,Z处于第四周期,Z的原子序数大于18,若Y为Na元素,则Z为Ca元素,若Y为Mg元素,则Z为K元素,X的原子序数再增大,不符合题意,由于元素W与Y形成的化合物M的熔点最高,故Y为Mg元素,Z为K元素。
解答:(1)W为氧元素,O原子的L层电子排布式为2s22p4;O3中心O原子成2个σ键,含有1对孤对电子,杂化轨道用于成σ键或填充孤对电子对,故杂化轨道数为2+1=3,由于中心O原子含有1对孤对电子,故O3空间构型为V型;(2)F2与水反应生成氢氟酸和氧气,发生反应的化学方程式为2F2 +2H2O =4 HF+ O2 ;(3)由上述分析可知,M为MgO,其晶体结构与NaCl相同,而熔点高于NaCl,由于MgO晶体中离子的电荷多,晶格能大,故MgO熔点较高。在碳酸二甲酯分子中,酯基中C原子呈2个C-O单键,属于σ键,1个C=O双键,双键按单键计算,故中心C原子的杂化轨道数为3,采取sp2杂化,为平面正三角形,键角为120°,故O-C-O的键角约为 120° 。(4) (4)F、Mg、K形成立方晶体结构的化合物,晶胞中F占据所有棱的中心,晶胞中F原子数目为12×![]() =3,Mg位于顶角,晶胞中Mg原子数目为8×
=3,Mg位于顶角,晶胞中Mg原子数目为8×![]() =1,K处于体心位置,晶胞中含有1个K原子,则该晶体的组成为F:Mg:K=3:1:1;(5)含有元素K的盐的焰色反应为紫色。许多金属盐都可以发生焰色反应,其原因是激发态电子从能量高的轨道跃迁到回到能量低的轨道时,以一定波长(可见光区域)光的形式释放能量。
=1,K处于体心位置,晶胞中含有1个K原子,则该晶体的组成为F:Mg:K=3:1:1;(5)含有元素K的盐的焰色反应为紫色。许多金属盐都可以发生焰色反应,其原因是激发态电子从能量高的轨道跃迁到回到能量低的轨道时,以一定波长(可见光区域)光的形式释放能量。


 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】化学家在探索物质结构与性质方面做出了杰出贡献,发现元素周期律并绘制第一张元素周期表的化学家是( )
A.门捷列夫
B.汤姆生
C.卢瑟福
D.道尔顿
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应A2+ B2![]() 2AB △H=QkJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线。下列有关说法正确的是
2AB △H=QkJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线。下列有关说法正确的是
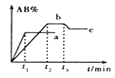
A. △H>0 B. AB一定是气体物质
C. 反应温度a低于b D. A2、B2中最少有一种是气态物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于丙烯(CH3﹣CH=CH2)的说法正确的( )
A.丙烯分子有7个δ键,1个π键
B.丙烯分子中3个碳原子都是sp3杂化
C.丙烯分子存在非极性键
D.丙烯分子中3个碳原子在同一直线上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种金属,进行如下实验:①将A与B浸在稀硫酸中用导线相连,A逐渐溶解,B上有气泡逸出;②将A、D分别投入等浓度盐酸中,D比A反应剧烈;③将B浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是
A.D>C>A>B B.D>A>B>C
C.D>B>A>C D.B>A>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在15 mL0.10 mol·L-1NaOH 溶液中逐滴加入 0.20 mol·L-1 的氢氰酸(HCN,一元弱酸)溶液,溶液的pH和加入的氢氰酸溶液的体积关系曲线如下图所示,有关粒子浓度大小关系正确的是

A. 在 A、B 间任意一点:c(Na+)﹥c(CN-)﹥c(OH-)﹥c(H+)
B. 在 B 点:c(Na+) = c(CN-)﹥c( OH-) = c(H+),且 a=7.5
C. 在 C 点:c(CN-)﹥c(Na+)﹥c(OH-)﹥c(H+)
D. 在 D 点:c(HCN) + c(CN-)﹥2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.汽油、柴油和植物油都是碳氢化合物
B.乙醇可以被氧化为乙酸,二者都能发生酯化反应
C.甲烷、乙烯和苯在工业上都可通过石油分馏得到
D.含5个碳原子的有机物,每个分子中最多可形成4个C-C单键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛的化合物如TiO2、Ti(NO3)4、TiCl4、 Ti(BH4)2等均有着广泛用途。
(1)写出Ti的基态原子的外围电子排布式____________。
(2)TiCl4熔点是-25℃,沸点136.4℃,可溶于苯或CCl4,该晶体属于_____晶体;BH4-中B原子的杂化类型为____________;
(3)在 TiO2催化作用下,可将CN-氧化成CNO-,进而得到N2。与CNO-互为等电子体的分子化学式为_________________。
(4)Ti3+可以形成两种不同的配合物:[Ti(H2O)6]Cl3(紫色),[TiCl(H2O)5]Cl2H2O(绿色),两者配位数_____(填“相同”或“不同”),绿色晶体中配体是______。

(5)TiO2难溶于水和稀酸,但能溶于浓硫酸,析出含有钛酰离子的晶体,钛酰离子常成为链状聚合形式的阳离子,其结构形式如图1,化学式为____________。
(6)金属钛内部原子的堆积方式是面心立方堆积方式,如图2。若该晶胞的密度为![]() g/cm3,阿伏加德罗常数为NA,则该晶胞的边长为______________cm。
g/cm3,阿伏加德罗常数为NA,则该晶胞的边长为______________cm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com