
【题目】钛的化合物如TiO2、Ti(NO3)4、TiCl4、 Ti(BH4)2等均有着广泛用途。
(1)写出Ti的基态原子的外围电子排布式____________。
(2)TiCl4熔点是-25℃,沸点136.4℃,可溶于苯或CCl4,该晶体属于_____晶体;BH4-中B原子的杂化类型为____________;
(3)在 TiO2催化作用下,可将CN-氧化成CNO-,进而得到N2。与CNO-互为等电子体的分子化学式为_________________。
(4)Ti3+可以形成两种不同的配合物:[Ti(H2O)6]Cl3(紫色),[TiCl(H2O)5]Cl2H2O(绿色),两者配位数_____(填“相同”或“不同”),绿色晶体中配体是______。

(5)TiO2难溶于水和稀酸,但能溶于浓硫酸,析出含有钛酰离子的晶体,钛酰离子常成为链状聚合形式的阳离子,其结构形式如图1,化学式为____________。
(6)金属钛内部原子的堆积方式是面心立方堆积方式,如图2。若该晶胞的密度为![]() g/cm3,阿伏加德罗常数为NA,则该晶胞的边长为______________cm。
g/cm3,阿伏加德罗常数为NA,则该晶胞的边长为______________cm。
【答案】3d24s2分子晶体sp3CO2(或N2O、CS2、BeCl2等合理均可给分,写成离子的不得分)相同Cl﹣、H2O[TiO]n2n+![]()
【解析】(1)钛是22号元素,根据构造原理知其基态核外电子排布式为1s22s22p63s23p63d24s2,则其基态原子的外围电子排布式为3d24s2 ;
(2)因TiCl4在常温下是无色液体,熔点-23.2℃,沸点136.2℃,熔沸点低,由此可判断 TiCl4是由共价键结合的分子,晶体类型属于分子晶体,BH4-中B原子价层电子对=4+![]() (3+1-4×1)=4,且没有孤电子对,则BH4-中B原子的杂化类型为sp3;
(3+1-4×1)=4,且没有孤电子对,则BH4-中B原子的杂化类型为sp3;
(3)CNO-中含有3个原子,16个价电子,所以其等电子体中分子为:CO2(或N2O、CS2、BeCl2等),离子为:SCN-或(N3-)等;
(4)[Ti( H2O)6]Cl3(紫色),配体为:H2O,配位数为6,[TiCl(H2O)5]Cl2H2O(绿色),配体为Cl-、H2O,配位数为6,两者配位数相同;
(5)每个O原子被两个Ti原子共用、每个Ti原子被两个O原子共用,利用均摊法计算二者原子个数之比为1:1;Ti元素为+4价、O元素为-2价,据此书写其化学式为[TiO]n2n+;
(6)在每个钛的晶胞中含有钛原子数为8×![]() +6×
+6×![]() =4,设晶胞的连长为a,根据ρ=
=4,设晶胞的连长为a,根据ρ=![]() 有,ρ=
有,ρ=![]() ,所以a=
,所以a=![]() cm=
cm=![]() cm。
cm。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】
主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子效的3倍。X、Y和Z分属不同的周期,它们的原子序教之和是W 原子序数的5倍。在由元素W、X、Y、Z组成的所有可能的二元化合物中.由元素W与Y形成的化合物M的熔点最高。
请回答下列问题:
(1)W元素原子的L层电子排布式为__________,W3分子的空间构型为______;
(2)X单质与水发生主要反应的化学方程式为_____________;
(3)化合物M的化学式为_______,其晶体结构与NaCl相同,而熔点高于NaCl。M熔点较高的原因是_________。将一定量的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中,碳原子采用的杂化方式有___________,O-C-O的键角约为_______;
(4)X、Y、Z可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角,Z处于体心位置,则该晶体的组成为X:Y:Z=___________;
(5)含有元素Z的盐的焰色反应为_____色。许多金属盐都可以发生焰色反应,其原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1~18号元素的离子aW3+ , bX+ , cY2﹣ , dZ﹣都具有相同的电子层结构,下列关系正确的是( )
A.质子数:c>d
B.离子的还原性:Y2﹣>Z﹣
C.氢化物的稳定性:H2Y>HZ
D.原子半径:X<W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3溶液和Fe(OH)3胶体共同具备的性质是
A.加入饱和NaCl溶液都产生沉淀 B.加入盐酸先产生沉淀,后沉淀溶解
C.分散质的粒子都能通过滤纸 D.都能产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知
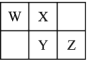
A. X、Y、Z中最简单氢化物稳定性最弱的是Y
B. 元素氧化物对应水化物的酸性:Z>Y
C. 元素形成的单核阴离子还原性:X>Y
D. Z元素单质在化学反应中只表现氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常通过高温分解FeSO4的方法制备Fe2O3,为检验FeSO4高温分解的产物,并进行有关探究实验,回答下列问题:
实验一:高温分解FeSO4,利用如图所示的实验装置进行实验。
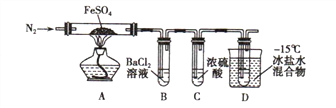
已知:①SO2熔点为-72℃,沸点为-10℃ ② SO3熔点为-16.8℃,沸点为44.8℃
(1)连接装置,检验气密性良好,放入药品,通入一段时间N2然后加热,通入N2的目的是_________________________
(2)隔绝空气加热至650℃,看到B中有白色沉淀,D试管中有无色液体,硬质玻璃管中的固体变为_________色,写出该反应的化学方程式___________________。
(3)反应完毕后,停止加热冷却后,取硬质玻璃管中固体,加盐酸,反应的离子方程式是__________________, 将反应后所得溶液滴入D试管中,溶液变为浅绿色,该反应的离子方程式是 _______________
实验二 探究高温分解 FeSO4生成的气体
(4)用如图所示装置设计实验,验证高温分解FeSO4生成的气态物质
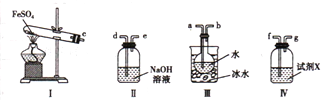
①按气流方向连接各仪器,用字母表示接口的连接顺序:c-__________________________
②试剂X的名称是 ___________________________
③充分反应后,利用装置III中圆底烧瓶内混合物测定已分解的FeSO4 的质量,向圆底烧瓶中逐渐滴入氯化钡溶液,直到沉淀完全;然后过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重。若最终得到沉淀的质量为Wg ,则已分解的FeSO4的质量 ________________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质中,属于芳香族化合物的是 ,属于芳香烃的是 ,属于苯的同系物的是 。(填编号)
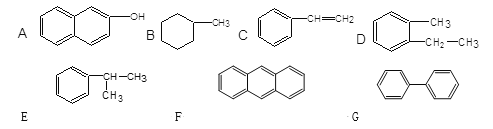
(2)已知芳香烃A是煤焦油分馏出的一种组分。A不与溴水反应,但能使高锰酸钾酸性溶液褪色。1 mol A在镍催化剂的作用下,可与3 mol H2发生加成反应。0.5 mol A完全燃烧,生成3.5 mol CO2和2 mol H2O。通过计算推断A的名称是 。写出A与浓硝酸、浓硫酸混合酸在100℃时反应的化学方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al、Fe、Cu都是重要而常见的金属,下列有关说法正确的是( )
A. 生活中常用的是它们的合金材料
B. 三者的单质放置在空气中均只生成氧化物
C. 三者所对应的氢氧化物在水中都存在溶解平衡
D. 工业上制备这三种金属的方法依次为电解法、热分解法和热还原法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有MgSO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol/L,Mg2+ 的物质的量浓度为0.3mol/L,则此溶液中SO42- 的物质的量浓度为
A.0.9 mol/L B.1.8 mol/L C.0.7mol/L D.0.5mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com