
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0 mol NO2和1.0 mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0 mol NO2和1.0 mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 3 | 6 | 12 | 24 |
n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
下列有关说法正确的是
A.反应在0~3 s内的平均速率v(NO2)=0.24 mol·L1·s1
B.24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44 mol·L1,则反应的ΔH>0
C.在T温度下,起始时向容器中充入2.0 mol N2O5和2.0 mol O2,达到平衡时,N2O5的转化率大于20%
D.在T温度下,起始时向容器中充入1.0 mol NO2、0.5 mol O3和0.50 mol N2O5、0.50 mol O2,反应达到平衡时,压强为起始时的0.88倍
【答案】D
【解析】本题考查化学反应速率和化学平衡。A.反应在0~3 s内的平均速率v(NO2)=2v(O2)=2![]() =0.12mol·L1·s1,错误;B.24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44 mol·L1大于原平衡氧气的浓度,则降温平衡正向移动,反应的ΔH<0,错误;C.在T温度下,起始时向容器中充入1.0 mol N2O5和1.0 mol O2等效于原平衡,达到平衡时,N2O5的物质的量与原平衡相同,为0.8 mol,转化率为20%,起始时向容器中充入2.0 mol N2O5和2.0 mol O2,若平衡不移动,达到平衡时,N2O5的转化率等于20%,而压强增大使平衡正向移动,因此N2O5的转化率小于20%,错误;D.在T温度下,起始时向容器中充入1.0 mol NO2、0.5 mol O3和0.50 mol N2O5、0.50 mol O2,与原平衡等效,有0.4mol NO2、0.2 mol O3和0.80 mol N2O5、0.80 mol O2,反应达到平衡时,压强为起始时的
=0.12mol·L1·s1,错误;B.24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44 mol·L1大于原平衡氧气的浓度,则降温平衡正向移动,反应的ΔH<0,错误;C.在T温度下,起始时向容器中充入1.0 mol N2O5和1.0 mol O2等效于原平衡,达到平衡时,N2O5的物质的量与原平衡相同,为0.8 mol,转化率为20%,起始时向容器中充入2.0 mol N2O5和2.0 mol O2,若平衡不移动,达到平衡时,N2O5的转化率等于20%,而压强增大使平衡正向移动,因此N2O5的转化率小于20%,错误;D.在T温度下,起始时向容器中充入1.0 mol NO2、0.5 mol O3和0.50 mol N2O5、0.50 mol O2,与原平衡等效,有0.4mol NO2、0.2 mol O3和0.80 mol N2O5、0.80 mol O2,反应达到平衡时,压强为起始时的![]() =0.88倍,正确。故选D。
=0.88倍,正确。故选D。


科目:高中化学 来源: 题型:
【题目】有下列各组物质:(A) O2和O3; (B) ![]() ;
; 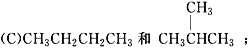
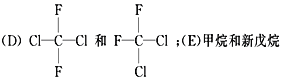
(1)__________组两物质互为同位素;(2)__________组两物质互为同素异形体;
(3)__________组两物质互为同系物;(4)__________组两物质互为同分异构体;
(5) _________组两物质互为同一物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NO2与N2O4 可相互转化: 2NO2( g)![]() N2O4(g) △H=24.2 kJ mol1,在恒温下, 将一定量和N2O4的混合气体充入体积为2 L的密闭容器中,其中物质的浓度随时间变化的关系如图所示。下列推理分析不合理的是
N2O4(g) △H=24.2 kJ mol1,在恒温下, 将一定量和N2O4的混合气体充入体积为2 L的密闭容器中,其中物质的浓度随时间变化的关系如图所示。下列推理分析不合理的是

A.前10 min内,用v(NO2)表示的反应速率为0. 02 molL1min1
B.反应进行到10 min时,体系吸收的热量为9.68 kJ
C.b、d两点中v(正)与v(逆)均相等
D.25 min时,正反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是
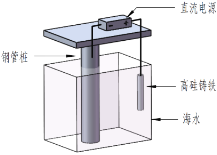
A.通入保护电流使钢管桩表面腐蚀电流接近于零
B.通电后外电路电子被强制从高硅铸铁流向钢管桩
C.高硅铸铁的作用是作为损耗阳极材料和传递电流
D.通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期非金属元素甲~丁在元素周期表中的相对位置如下表所示,下列判断正确的是( )
甲 | 乙 | |
丙 | 丁 |
A. 原子半径:甲<乙
B. 原子最外层电子数:甲>丁
C. 原子核外电子层数:丙>甲
D. 元素的最高价氧化物对应水化物的酸性:丁<丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上冶炼锡的第一步反应原理为2SnO2 + 3C![]() 2Sn + aM↑+ CO2↑,则下列说法中错误的是( )
2Sn + aM↑+ CO2↑,则下列说法中错误的是( )
A. 反应中SnO2被还原 B. a的值为3
C. 反应后有两种氧化产物 D. 每生成1 mol CO2转移电子8 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(17分)下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白(填写序号不得分):
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:_____。(填元素符号)
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是/span>______,碱性最强的化合物的化学式是:__________。
(3)比较①与⑤的最高价氧化物对应的水化物,_________的酸性强(填化学式);能通过________________________________说明(写反应的化学方程式)。
(4)实验室制取②的氢化物的化学方程式_______________________________ ,②的氢化物与②的最高价氧化物的水化物反应所得的产物化学式为______
(5)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因________________(用化学方程式表示)
(6)比较③与⑥的氢化物,_________ 更稳定(填化学式)
(7)写出④的单质与水反应的离子方程式_______________________。
(8)写出⑦元素的离子结构示意图______,该离子半径_________ S2-(填“﹥”或“﹤”)写出⑩元素在周期表的位置_______________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com