
【题目】如图是碳酸钙(CaCO3)在25℃和100℃两种情况下,在水中的沉淀溶解平衡曲线。下列有关说法正确的是
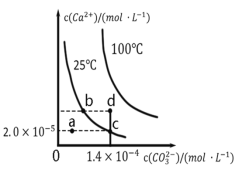
A.CaCO3(s)![]() Ca2+(aq)+CO32—(aq)ΔH<0
Ca2+(aq)+CO32—(aq)ΔH<0
B.a、b、c、d四点对应的溶度积Ksp关系:d﹥b﹥c﹥a
C.25℃时,蒸发溶剂可能使溶液由a点变为曲线上b、c之间的某一点(不含b、c)
D.25℃时CaCO3的Ksp=2.8×10-9,d点无沉淀生成
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】在500 mL KNO3和Cu(NO3)2的混合溶液中,c(NO3-)=6 mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
A. 电解得到的Cu的物质的量为0.5 mol
B. 向电解后的溶液中加入98 g的Cu(OH)2可恢复为原溶液
C. 原混合溶液中c(K+)=4 mol/L
D. 电解后溶液中c(H+)=2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-等离子。向该溶液中滴加NaOH溶液,生成沉淀的物质的量变化曲线如图所示。下列有关判断正确的是 ( )
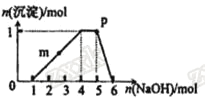
A.m点处反应:H++OH-=H2O
B.p点:c(OH-)>c(NH4+)>c(H+)
C.若取原溶液做焰色反应实验,焰色应为黄色
D.原溶液中存在的主要离子:n(H+)=2n(NH4+)=n(Al3+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①一⑧在表中的位置,用化学用语回答下列问题:
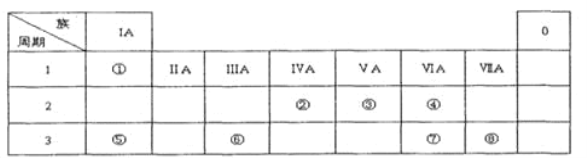
Ⅰ.(1)请画出元素⑧的阴离子结构示意图_________。
(2)④、⑤、⑦的原子半径由小到大的顺序为________。
(3)⑤和⑥的最高价氧化物对应水化物的碱性强弱为_______>______。
(4)④、⑤两种元素的原子按1:1组成的常见化合物的电子式为__________。
Ⅱ.由表中①一⑧中的一种或几种元素形成的常见物质A、B、C可发生以下反应(副产物已略去),试回答:
![]()
(1)若X是一种常见过渡金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,C溶液中金属离子与氢氧化钠溶液反应的产物在空气中发生颜色变化的方程式________;又知在酸性溶液中该金属离子能被双氧水氧化,写出该反应的离子方程式_________________。
(2)若A、B、C为含有同一金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为______,写出A与C两溶液反应的离子方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.32![]() 中含有的氧原子数是2×6.02×1023
中含有的氧原子数是2×6.02×1023
B.N2和CO共1mol的混合气体中含有的分子总数是2×6.02×1023
C.2.3 g Na与O2完全反应生成3.6 g产物时失电子数是0.1×6.02×1023
D.1.0 L 0.1 mol·L-1NH4NO3溶液中含有的铵根离子数是0.1×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1 mol·L-1 NaOH溶液滴定40 mL 0.1 mol·L-1 H2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。下列叙述错误的是( )
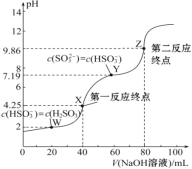
A. Ka2(H2SO3)的数量级为10-8
B. 若滴定到第一反应终点,可用甲基橙作指示剂
C. 图中Z点对应的溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)
D. 图中Y点对应的溶液中:3c(SO32-)=c(Na+)+c(H+)-c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
已知化学键键能数据如表:
化学健 | C﹣H | C=O | H﹣H | C≡O(CO) | ||
键能(kJ/mol) | 413 | 745 | 436 | 1075 |
(1)①CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。则该反应的△H=_____________。
2CO(g)+2H2(g)。则该反应的△H=_____________。
②在恒容绝热条件下,一定能说明该反应已达平衡状态的是_____________。(填字母)
A.混合气体的密度不再变化B.混合气体的平均相对分子质量不再变化
C.容器内的温度不再变化D.v正(CH4)=2v逆(H2)
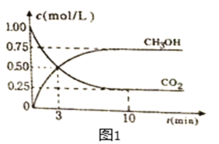
(2)利用CO2可制取甲醇,其反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);△H=-49.0KJ/mol;为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在恒温恒容密闭容器中,充入2molCO2和6molH2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图1所示。从反应开始到平衡,v(H2)=_____________;该温度下的平衡常数数值=_____________(保留三位有效数字)。
CH3OH(g)+H2O(g);△H=-49.0KJ/mol;为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在恒温恒容密闭容器中,充入2molCO2和6molH2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图1所示。从反应开始到平衡,v(H2)=_____________;该温度下的平衡常数数值=_____________(保留三位有效数字)。
(3)下列措施能使![]() 增大的是________。
增大的是________。
A.降低温度
B.恒温恒容下,再充入2molCO2、6molH2
C.使用高效催化剂
D.恒温恒容充入He(g)使体系压强增大
(4)一种熔融碳酸盐燃料电池原理示意如图2。
①该电池的负极反应式为_____________
②电池工作时,CO32﹣向电极_____________移动(填A或者B)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:乙炔的结构为H—C≡C—H,4个原子在同一直线上,能与单质溴发生加成反应,1,4-二苯基丁二炔广泛应用于农药的合成,其结构如图所示。下列有关该物质的说法不正确的是( )
![]()
A.该有机物的化学式为C16H10
B.该分子中处于同一直线上的原子最多有6个
C.该物质能使溴的四氯化碳溶液褪色
D.该分子中所有原子可能位于同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合元素周期表,完成下列问题。
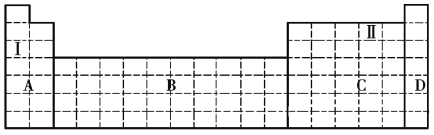
(1)在元素周期表中全部是金属元素的区域为______(填序号)。
a.A b.B c.C d.D
(2)Ⅰ和Ⅱ元素形成的化合物的化学式为______、______,它们都是____________(填“共价化合物”或“离子化合物”)。
(3)现有甲、乙两种元素,在火山口和火山附近的温泉中有甲元素的单质出现,乙元素是唯一一种原子序数比甲元素大的短周期主族元素。
①将甲、乙两元素的元素符号填写在上面元素周期表中对应的位置。______
②甲、乙两元素中,非金属性较强的是______(填元素名称),可以验证该结论的实验现象是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com