
| V |
| Vm |
| 4.48L |
| 22.4L/mol |
| V |
| Vm |
| m |
| M |
| N |
| NA |


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
| A、催化性 | B、氧化性 |
| C、还原性 | D、既有氧化性又有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用新制氢氧化铜悬浊液可检验失去标签的乙醇、丙三醇、乙醛、乙酸四瓶无色溶液 |
| B、检验氯乙烷中的氯元素时,可先将氯乙烷硝酸进行酸化,再加硝酸银溶液来检验,通过观察是否有白色沉淀来判断是否存在氯元素 |
| C、摩尔盐制备过程中铁屑要先用碳酸钠溶液浸泡洗涤,使用热的碳酸钠溶液有利提高去油污的能力,最后分离溶液和固体时不可以用倾析法 |
| D、由于苯酚与溴水发生反应时,副反应多,所以只能利用溴水对含苯酚的废水作定性检验,不能用作定量测定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
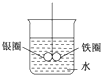 如图所示的装置,在铁圈和银圈的焊接处,用一根棉线将其悬吊在盛水的烧杯中,使之平衡.小心地向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是( )
如图所示的装置,在铁圈和银圈的焊接处,用一根棉线将其悬吊在盛水的烧杯中,使之平衡.小心地向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是( )| A、铁圈和银圈左右摇摆不定 |
| B、保持平衡状况 |
| C、银圈向下倾斜 |
| D、铁圈向下倾斜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
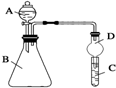 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com