
【题目】某有机物A,由C、H、O三种元素组成,在一定条件下,由A可以转化为有机物B、C、D、E;C又可以转化为B、D。它们的转化关系如图: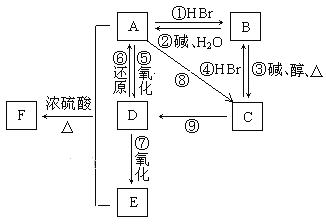
已知D的蒸气密度是氢气的22倍,并可以发生银镜反应。
(1)写出A、E的结构简式和所含官能团名称:A、___,E、___。
(2)写出D发生银镜反应的化学方程___;
(3)从组成上分析反应⑨是___(填反应类型)。
(4)F的同分异构体中能与NaOH溶液发生反应的共___种,写出其中一种与NaOH溶液反应的化学方程式___。
【答案】C2H5OH 、羟基 CH3COOH 、羧基 CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+2Ag↓+3NH3+H2O 氧化反应 6 CH3CH2CH2COOH+NaOH
CH3COONH4+2Ag↓+3NH3+H2O 氧化反应 6 CH3CH2CH2COOH+NaOH![]() CH3CH2CH2COONa+H2O(合理即可)
CH3CH2CH2COONa+H2O(合理即可)
【解析】
D的蒸气密度是氢气的22倍,则相对分子质量为44,含有-CHO,则D为CH3CHO,由图中转化关系可知E为CH3COOH,A为CH3CH2OH,B为CH3CH2Br,C为CH2=CH2,则F为CH3COOC2H5。
(1)A、E的结构简式和所含官能团名称:A:C2H5OH 、羟基 ,E:CH3COOH 、羧基,故答案为: A:C2H5OH 、羟基 ;D:CH3COOH 、羧基;
(2)D为乙醛,发生银镜反应,是醛基的还原性被弱氧化剂氧化为乙酸,发生了氧化反应,反应的化学方程式为:CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+2Ag↓+3NH3+H2O,故答案为:CH3CHO+2Ag(NH3)2OH
CH3COONH4+2Ag↓+3NH3+H2O,故答案为:CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+2Ag↓+3NH3+H2O;
CH3COONH4+2Ag↓+3NH3+H2O;
(3)C为CH2=CH2,D为CH3CHO,从组成上分析,是获得氧原子的反应,反应⑨是氧化反应。故答案为:氧化反应。
(4)F为乙酸乙酯,F的同分异构体中能与NaOH溶液发生反应有酯类,其结构简式为HCOOCH2CH2CH3、HCOOCH(CH3)2、CH3CH2COOCH3、CH3COOCH2CH3,属于酸类的有:CH3CH2CH2COOH、(CH3)2CHCOOH,共6种,其中一种与NaOH溶液反应的化学方程式:CH3CH2CH2COOH+NaOH![]() CH3CH2CH2COONa+H2O(合理即可),故答案为:6;CH3CH2CH2COOH+NaOH
CH3CH2CH2COONa+H2O(合理即可),故答案为:6;CH3CH2CH2COOH+NaOH![]() CH3CH2CH2COONa+H2O(合理即可)。
CH3CH2CH2COONa+H2O(合理即可)。


科目:高中化学 来源: 题型:
【题目】废旧印刷电路板是一种电子废弃物。湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品,从而达到从废旧印刷电路板中提取铜的目的。某化学小组模拟该方法回收铜并制取胆矾,流程简图如下:回答下列问题:
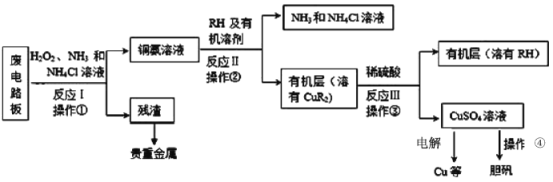
(1)反应Ⅰ是将Cu转化为Cu(NH3)42+,NH4Cl溶液主要作用是防止由于溶液中c(OH-)过高,生成__________(填化学式),影响铜的回收率。
(2)反应Ⅱ是铜氨溶液中的Cu(NH3)42+与有机物RH反应,操作2的名称是__________,操作2的主要其目的是(填序号)__________。
a.富集铜元素
b.增加Cu2+在水中的溶解度
c.使铜元素与水溶液中的物质分离
(3)反应Ⅲ的化学方程式为_______,若操作③使用下图装置,图中存在的错误有_______处。
(4)操作④由硫酸铜溶液制胆矾的主要步骤是__________过滤、洗涤、干燥。
(5)流程中可循环使用的试剂除了NH3和NH4Cl溶液以外,还有______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是一种重要的化工产品。它不溶于H2SO4、HNO3 和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[Cu2(OH)4-nCln],n随着环境酸度的改变而改变。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如图:
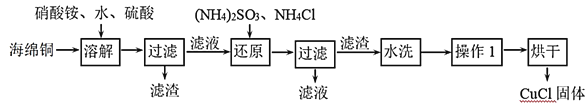
(1)还原过程中主要反应的离子方程式为_______。
(2)实验室为了加快过滤速度,往往采用抽滤的操作(如图)。仪器A的名称__________,有关抽滤,下列说法正确的是__________
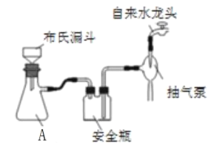
A.抽滤完毕,应先拆下连接抽气泵和吸滤瓶的橡胶管,再关闭水龙头,最后将滤液从吸滤瓶上口倒出
B.在布氏漏斗中放入滤纸后,直接用倾析法转移溶液和沉淀,再打开水龙头抽滤
C.在抽滤装置中洗涤晶体时,为减少晶体溶解损失,应使洗涤剂快速通过滤纸
D.减压过滤不宜用于过滤胶状或颗粒太小的沉淀
(3)操作1为马上再洗涤,然后在真空干燥机内于70℃干燥2h,冷却、密封包装。其中最合理的洗涤试剂__________
A. 浓盐酸 B. 浓氨水 C. 无水乙醇 D. 水+乙醇
真空干燥的原因是___________。
(4)随着pH减小,Cu2(OH)4-nCln中铜的质量分数__________
A. 增大 B. 不变 C. 减小 D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室产生的废液中的阳离子只可能含有Na+、NH4+、Ba2+、Cu2+、Al3+、Fe2+、Fe3+中的某几种,实验室设计了下述方案对废液进行处理,以回收金属,保护环境。
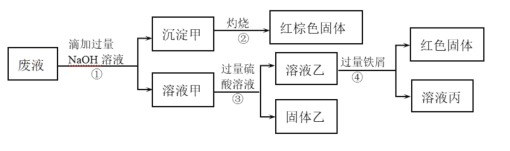
已知:步骤①中,滴加NaOH溶液过程中产生的沉淀会部分溶解。下列说法中正确的是
A.根据步骤①的现象,说明废液中一定含有Al3+
B.由步骤②中红棕色固体可知,废液中一定存在Fe3+
C.沉淀甲中可能含有Al(OH)3
D.该废液中一定含有NH4+、Ba2+、Cu2+、Fe2+和Fe3+至少存在一种
查看答案和解析>>
科目:高中化学 来源: 题型:
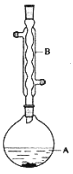
【题目】乙酸异戊酯是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图和有关数据如下:
![]() +H2O
+H2O
相对原子质量 | 密度/(g.cm-3) | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.8123 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
实验步骤:
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。回答下列问题:
(1)装置B的名称是:___。
(2)该反应中浓硫酸的作用___,若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式___。
(3)如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作___。
(4)在洗涤操作中,第一次水洗的主要目的是:___;第二次水洗的主要目的是:___。
(5)本实验中加入过量乙酸的目的是:___。
(6)在蒸馏操作中,仪器选择及安装都正确的是:___(填标号)
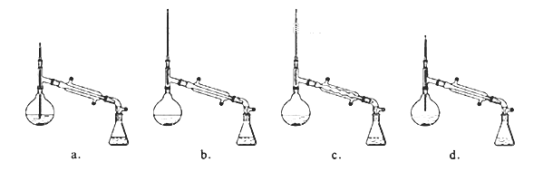
(7)本实验的产率是___。
A.30℅ B.40℅ C.50℅ D.60℅
(8)在进行蒸馏操作时,若从130℃开始收集馏分,产率偏___(填高或者低)原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含有少量杂质的硝酸铜固体用酒精灯加热至恒重,收集到20.20mL气体,再将该气体用足量水吸收,剩余2.10mL气体(气体体积在同温同压下测定),则杂质不可能
A.只是NaNO3B.只是AgNO3C.只是NaClD.是NaNO3和AgNO3的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
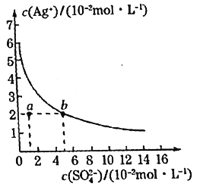
A.含有大量SO42-的溶液中肯定不存在Ag+
B.该温度下,Ag2SO4的溶度积常数(Ksp)的数量级是3
C.可以通过改变温度或加入硫酸银固体使a点移动到b点
D.该温度下,0.02mol·L-1的AgNO3溶液与0.2mol·L-1的Na2SO4溶液等体积混合,不会生成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在20 mL 0.1 mol·L-1一元弱酸HA溶液中滴加0. 1 mol· L-1 NaOH溶液,溶液中1g[c(A-)/c(HA)]与pH关系如图所示。下列说法正确的是

A. A点对应溶液中:c(Na+)>c(A-)>c(H+)>c(OH-)
B. 25℃时,HA酸的电离常数为1. 0× 10-5.3
C. B点对应的NaOH溶液体积为10 mL
D. 对C点溶液加热(不考虑挥发),则c(A-)/[c(HA)c(OH-)]一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D、E均为化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )

A. 若A是铁,则E可能为稀硝酸
B. 若A是CuO,E是碳,则B为CO
C. 若A是NaOH溶液,E是CO2,则B为NaHCO3
D. 若A是AlCl3溶液,E可能是氨水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com