
【题目】用下面的方案进行某些离子的检验,其中方案设计严密的是
A.检验试液中的SO42-:试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
B.检验试液中的NH4+:试液![]() 气体
气体![]() 试纸变蓝
试纸变蓝
C.检验试液中的I-:试液![]() 黄色溶液
黄色溶液![]() 深黄色溶液
深黄色溶液
D.检验试液中的Fe2+:试液![]() 无明显现象
无明显现象![]() 红色溶液
红色溶液
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】元素周期律与周期表是学习元素化合物知识的重要工具。C与Si,N与P分别位于同一主族。其气态氢化物的分解温度如下表:
物质 | CH4 | SiH4 | NH3 | PH3 |
分解温度/K | 873 | 773 | 1073 | T |
(1)CH4分解温度高于SiH4的原因是_________。
(2)仅依据元素非金属性强弱关系,预测PH3分解温度(T)的范围________;
(3)某同学为证明非金属性![]() ,设计如图装置:
,设计如图装置:
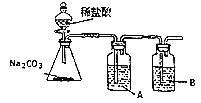
①A处盛放的试剂是__________;
②B中出现的现象是______;B处发生的离子反应方程式为_____________;
③该同学的设计中存在的问题是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取表面部分氧化的镁条8.00g溶于250mL4.00mol·L-1的稀盐酸中,向所得溶液中滴加未知浓度的NaOH溶液,产生沉淀的质量与NaOH溶液的体积关系如图所示:
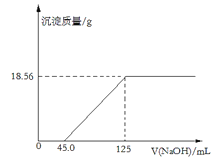
请计算:
(1)NaOH溶液的物质的量浓度___mol·L-1。
(2)样品中镁元素的质量___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由两种有机物组成的混合物,在一定的温度和压强下完全气化为气体.在相同的温度和压强下,只要混合气体体积一定,那么无论两物质以何种比例混合,其完全燃烧时所消耗的氧气体积就是一定的,符合这种情况的可能组合是:
A. 乙醇(![]() )和乙酸(
)和乙酸(![]() ) B. 乙醛(
) B. 乙醛(![]() )和甲醇(
)和甲醇(![]() )
)
C. 丙醛(![]() )和甘油(
)和甘油(![]() ) D. 丙酮(
) D. 丙酮(![]() )和丙二醇(
)和丙二醇(![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)合成高分子化合物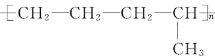 的单体是______;(写结构简式)
的单体是______;(写结构简式)
(2)1mol乳酸( ![]() )最多消耗_______molNa;两分子乳酸在浓硫酸加热的条件下,可生成一种环状酯,写出此酯的结构简式:__________;
)最多消耗_______molNa;两分子乳酸在浓硫酸加热的条件下,可生成一种环状酯,写出此酯的结构简式:__________;
(3)有机物M的结构简式为: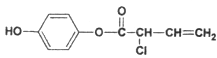 ,则:1 mol M最多消耗的H2、Br2的物质的量比值为_________________;1 mol M最多消耗NaOH的物质的量为______________mol.
,则:1 mol M最多消耗的H2、Br2的物质的量比值为_________________;1 mol M最多消耗NaOH的物质的量为______________mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表给出了14种元素的电负性:
元素 | 电负性 | 元素 | 电负性 | 元素 | 电负性 |
Al | 1.5 | B | 2.0 | Be | 1.5 |
C | 2.5 | Cl | 3.0 | F | 4.0 |
Li | 1.0 | Mg | 1.2 | N | 3.0 |
Na | 0.9 | O | 3.5 | P | 2.1 |
Cl | 2.5 | S | 1.8 |
(1)同一周期中,从左到右,主族元素的电负性_________;同一主族中,从上到下,元素的电负性_________。主族元素的电负性随原子序数递增呈_________变化。
(2)短周期元素中,电负性最大的元素与电负性最小的元素形成的化合物属于____________化合物,用电子式表示该化合物:___________________。
(3)已知:两成键元素间的电负性差值大于1.7时,通常形成离子键,两成键元素间的电负性差值小于1.7时,通常形成共价键,则Mg3N2、BeCl2、AlCl3、SiC中为离子化合物的是_________,为共价化合物的是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知溴乙烷(C2H5Br)是无色液体,沸点38.4℃,密度比水大,难溶于水,可溶于多种有机溶剂。在溴乙烷与NaOH乙醇溶液的消去反应中可以观察到有气体生成。有人设计了如图所示的装置,用KMnO4酸性溶液是否褪色来检验生成的气体是否是乙烯。

请回答下列问题:
(1)仪器a的名称为__________。
(2)实验前应检测装置A的气密性。方法如下:关闭止水夹c,由仪器a向仪器b中加水,若______________________________,则证明装置A不漏气。
(3)仪器b中发生反应的化学方程式为______________________________。
(4)反应开始一段时间后,在装置B底部析出了较多的油状液体,若想减少油状液体的析出,可对装置A作何改进?__________________________________________________
(5)装置A中产生的气体通入装置C之前要先通过装置B,装置B的作用为__________________。
(6)检验乙烯除用KMnO4酸性溶液外还可选用的试剂有__________,此时,是否还有必要将气体先通过装置B?__________(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)现有浓度均为![]() 的盐酸、硫酸、醋酸三种溶液,回答下列问题:
的盐酸、硫酸、醋酸三种溶液,回答下列问题:
(1)若三种溶液中![]() 分别为
分别为![]() ,则它们的大小关系为_________________________________________。
,则它们的大小关系为_________________________________________。
(2)等体积的以上三种酸分别与过量的![]() 溶液反应,若生成的盐的物质的量依次为
溶液反应,若生成的盐的物质的量依次为![]() ,则它们的大小关系为__________________________。
,则它们的大小关系为__________________________。
(3)分别用以上三种酸中和一定量的![]() 溶液生成正盐,若需要酸的体积分别为
溶液生成正盐,若需要酸的体积分别为![]() ,其大小关系为__________________________________。
,其大小关系为__________________________________。
(4)分别与锌反应,开始时生成氢气的速率为![]() ,其大小关系为______________________。
,其大小关系为______________________。
(二)有![]() 四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复)。
四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复)。
阳离子 |
|
阴离子 |
|
已知:①![]() 溶液的
溶液的![]() 均大于7,
均大于7, ![]() 的溶液中水的电离程度相同;②
的溶液中水的电离程度相同;②![]() 溶液和
溶液和![]() 溶液相遇时只生成白色沉淀,
溶液相遇时只生成白色沉淀, ![]() 溶液和
溶液和![]() 溶液相遇时只生成刺激性气味的气体,
溶液相遇时只生成刺激性气味的气体, ![]() 溶液和
溶液和![]() 溶液混合时无现象。
溶液混合时无现象。
(1) ![]() 是_________________________,
是_________________________,![]() 是_______________________(填化学式)。
是_______________________(填化学式)。
(2)写出![]() 和
和![]() 反应的离子方程式_________________________________。
反应的离子方程式_________________________________。
(3) ![]() 时,
时, ![]() 溶液的
溶液的![]() ,则
,则![]() 溶液中
溶液中![]() _________________________________________(用含有
_________________________________________(用含有![]() 的关系式表示)。
的关系式表示)。
(4)将等体积、等物质的量浓度的![]() 溶液和
溶液和![]() 溶液混合,反应后溶液中各种离子浓度由大到小的顺序是_________________________。
溶液混合,反应后溶液中各种离子浓度由大到小的顺序是_________________________。
(5)在一定体积的![]() 的
的![]() 溶液中,加入一定体积的
溶液中,加入一定体积的![]() 的盐酸,混合溶液的
的盐酸,混合溶液的![]() ,若反应后溶液的体积等于
,若反应后溶液的体积等于![]() 溶液与盐酸的体积之和,则
溶液与盐酸的体积之和,则![]() 溶液与盐酸的体积比是_______________。
溶液与盐酸的体积比是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com