
【题目】一定温度下,将 2 molSO2 和 1 molO2 充入一定容密闭容器中,在催化剂存在下进行下列反应: 2SO2(g)+O2(g)![]() 2SO3(g);△H=-197kJ/ mol,当达到平衡状态时,下列说法中正确的是
2SO3(g);△H=-197kJ/ mol,当达到平衡状态时,下列说法中正确的是
A. 生成 SO3为2 mol
B. 反应放出 197 kJ 的热量
C. SO2和SO3 物质的量之和一定为 2mol
D. SO2、O2、SO3的物质的量之比一定为2:1:2
【答案】C
【解析】
A.2molSO2和1molO2充入定容密闭容器中,若两者完全转化为SO3,得到SO3为2mol,但反应为可逆反应,不能完全转化,所以生成的SO3小于2mol,A项错误;
B.2molSO2和1molO2充入定容密闭容器中,若两者完全转化为SO3,放出的热量为197kJ,但反应为可逆反应,不能完全转化,所以反应放出热量小于197kJ,B项错误;
C.根2SO2(g)+O2(g)![]() 2SO3(g)可知,SO2的消耗量等于SO3的生成量,所以反应过程中SO2和SO3物质的量之和恒定,等于2mol,C项正确;
2SO3(g)可知,SO2的消耗量等于SO3的生成量,所以反应过程中SO2和SO3物质的量之和恒定,等于2mol,C项正确;
D.SO2、O2、SO3的物质的量之比不一定为2:1:2,注意SO2、O2、SO3的转化的物质的量之比等于化学计量数之比即2:1:2,D项错误。
故答案选C。


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】键能的大小可用于计算化学反应的反应热(△H)。
化学键 | Cl-Cl | H—H | H—Cl | N≡N |
键能/kJ·mol-1 | 243 | 436 | 431 | 946 |
(1)利用上表中的数据判断发生反应H2(g) + Cl2(g)= 2HCl(g)过程中,当生成1molHCl气体时需要___(填“吸收”或“放出” )____kJ能量。
(2)已知N2 (g)+3H2(g) = 2NH3(g) ΔH=-92 kJ/mol,则N—H键的键能是___kJ·mol-1。
(3)1molNO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化如下图,请写出NO2和CO反应的热化学方程式:____。

(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1
②2CO(g)+O2(g)=2CO2(g) ΔH2
③H2O(g)=H2O(l) ΔH3
则CH3OH(l)+O2(g)= CO(g) + 2H2O(l) ΔH=_______(用含ΔH1、ΔH2、ΔH3的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铝热剂和铝热反应的叙述错误的是
A.铝热剂的反应原理是利用铝的强还原性
B.铝热剂不只是指铝和氧化铁混合后的物质
C.铝热反应常用于冶炼高熔点金属
D.铝热反应需用镁带和氯酸钾引燃,所以铝热反应是一个吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题。
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为_______(写离子符号);若所得溶液c(HCO3-):c(CO32-)=2:1,溶液pH=______。(室温下,H2CO3的K1=4×10-7;K2=5×10-11)
(2)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g) ![]() (2CO(g)+2H2(g)
(2CO(g)+2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol-1 | 413 | 745 | 436 | 1075 |
则该反应的△H=___________。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是____________(填“A”或“B”)
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如下图所示。此反应优选温度为900℃的原因是_______________。
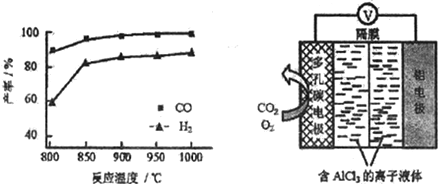
(3)O2辅助的A1-CO2电池工作原理如上图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的正极反应式:6O2+6e-=6O2- 6CO2+6O2-=3C2O42-+6O2
反应过程中O2的作用是_______________。该电池的总反应式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
![]()
![]() 【题目】实验室将9g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所得固体中含金属单质为18g,则该氧化物粉末可能是( )
【题目】实验室将9g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所得固体中含金属单质为18g,则该氧化物粉末可能是( )
![]()
![]() A.
A.![]() B.
B.![]() 和
和![]()
C.![]() 和
和![]() D.
D. ![]() 和FeO
和FeO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级TiO2是一种光催化材料,可处理甲醛、氮氧化物等污染物,工业上也可用其催化乙醇脱氢制备乙醛:CH3CH2OH![]() CH3CHO + H2↑。
CH3CHO + H2↑。
(1)Ti原子基态核外电子排布式为____。
(2)CH3CHO分子中碳原子轨道的杂化类型是____,1 mol CH3CHO分子中含有 σ 键的数目为____。
(3)与NO互为等电子体的一种阳离子为____(填化学式)。
(4)乙醇可以与水以任意比互溶,除因为它们都是极性分子外,还因为____。
(5)一种TiO2的晶胞结构如图所示,其中与每个氧原子直接相连的钛原子数目为____。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 16g18O2的中子数为10NAB. 1.9g1H37Cl的电子数为0.9NA
C. 7.0g35Cl2的体积为2.24LD. 35Cl2的摩尔质量为70g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com