
| A、石灰石高温分解 |
| B、氢氧化钡晶体与氯化铵晶体反应 |
| C、二氧化碳与碳反应 |
| D、铝与盐酸反应 |
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
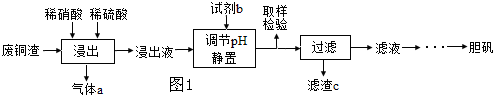
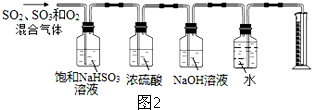
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaCl2 |
| B、HCl |
| C、NaOH |
| D、Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100ml |
| B、25ml |
| C、50ml |
| D、由于Mg、MgO的质量未知无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、自然界中金属元素比非金属元素多 |
| B、金属单质一般属于金属晶体 |
| C、导电、导热、延展性好、高熔点是金属的通性 |
| D、金属原子一般叫容易失去电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com