
【题目】下列实验中,现象及得出的结论正确的是()
实验 | 现象 | 结论 | |
A |
| 试管(1)中紫色褪去, 试管(2)中紫色未褪 | 甲基使苯环的活性增强 |
B |
| 试管内壁有 银镜生成 | 有机物X中一定含有醛基 |
C | 向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜悬浊液并加热 | 未见砖红色沉淀 | 淀粉未水解 |
D |
| 最后一只试管中有浅黄色沉淀 | 有机物中含有溴原子 |
A.AB.BC.CD.D
 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】下列关于金属腐蚀与防护的说法不正确的是

A.图①,放置于干燥空气中的铁钉不易生锈
B.图②,若断开电源,钢闸门将发生析氢腐蚀
C.图②,若将钢闸门与电源的负极相连,可防止钢闸门腐蚀
D.图③,若金属M 比 Fe 活泼,可防止输水管腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,在生产和生活中应用十分广泛。地康法制取氯气的反应为:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)△H= -120kJ/mol 该反应分两步进行,其基本原理如下图所示:
2Cl2(g)+2H2O(g)△H= -120kJ/mol 该反应分两步进行,其基本原理如下图所示:

过程 I 的反应为, 2HCl(g)+CuO(s) ![]() CuCl2(s)+H2O(g)△H= -132kJ/mol
CuCl2(s)+H2O(g)△H= -132kJ/mol
(1)该原理中起到催化剂作用物质的化学式为_______________________;
(2)过程 II 反应的热化学方程式为____________________;
(3)压强为p1时,地康法中HCl 的平衡转化率aHCl 随温度变化曲线如图。

①比较 a、b 两点的平衡常数大小 K(a)=_______________K(b)(填“>”“<”或“=”),解释原因为________________;
②c 点表示投料不变, 350℃、压强为p2时,地康法中HCl 的平衡转化率,则p2_________________p1(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是生产钛白的副产品,价格低,以硫酸亚铁为原料制备高效净水剂高铁酸钾(K2FeO4)可大大降低成本。其生产工艺如下:

已知:NaNO2是在空气中将Fe2+氧化为铁黄(FeOOH)的催化剂;铁黄微溶于酸。
请回答下列问题:
(1)铁黄(FeOOH)中铁元素的化合价是________。写出反应①生成铁黄(FeOOH)的离子方程式:____________________________,在通入O2“氧化”FeSO4的过程中,溶液的pH________(填“增大”“减小”或“不变”)
(2)写出反应③的化学方程式:___________________________________________。
(3)K2FeO4可作为新型多功能水处理剂的原因是_____________________________。
(4)该工艺每消耗标准状况下112LCl2理论上得到________gK2FeO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化六氨合钴[Co(NH3)6]Cl3是橙黄色、微溶于水的配合物,是合成其它一些含钴配合物的原料。如图是某科研小组以含钴废料(含少量Fe、Al等杂质)制取[Co(NH3)6]Cl3的工艺流程:
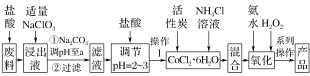
写出加“适量NaClO3”发生反应的离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O}(相对分子质量:288)可由乳酸与FeCO3反应制得,它易溶于水,几乎不溶于乙醇,受热易分解,是一种很好的补铁剂。
I.制备碳酸亚铁:装置如图所示。

(1)仪器B的名称是_________________________。
(2)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是:__________,然后关闭活塞1,接下来的操作是:______。C中发生反应的离子方程式为_____________。
Ⅱ.制备乳酸亚铁:
向纯净的FeCO3固体加入足量乳酸溶液,在75℃下搅拌使之充分反应。
(3)该反应化学方程式为______。为防止乳酸亚铁变质,在上述体系中还应加入____。反应结束后,从所得溶液中获得乳酸亚铁晶体的方法是:_________,冷却结晶,过滤,_________,干燥。
Ⅲ.乳酸亚铁晶体纯度的测量:
(4)用K2Cr2O7滴定法测定样品中Fe2+的含量计算样品纯度,称取6.00g样品配制成250.00mL溶液.取25.00mL用0.0167mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗标准液20.00mL。则产品中乳酸亚铁晶体的纯度为___(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。

(1)2﹣羟基异丁酸乙酯的分子式为_________,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_________个吸收峰;
(2)①②的反应类型分别为_________,_________;
(3)已知I为溴代烃,I→B的化学方程式为_________;
(4)缩聚产物F的结构简式为_________;
(5)下列关于![]() 和
和 的说法正确的有_________(双选,填字母);
的说法正确的有_________(双选,填字母);
A.后者遇到FeCl3溶液显紫色,而前者不可
B.两者都可以与NaHCO3溶液反应放出CO2
C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等
D.两者都可以与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有浓度均为0.5 mol![]() 的四种溶液:
的四种溶液:
①Na2CO3;②NaHCO3;③HCl;④NH3![]() H2O。
H2O。
(1)上述溶液中,可发生水解的是_____(填序号)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为_______。
(3)向溶液④中加入少量氯化铵固体,此时![]() 的值_____(填“增大”“减小”或“不变”),c(OH-)变____(填“变大”“变小”或“不变”)
的值_____(填“增大”“减小”或“不变”),c(OH-)变____(填“变大”“变小”或“不变”)
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积____④的体积(填“大于”“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是___。
(5)取10 mL溶液③,加水稀释到500 mL,则该溶液中由水电离出的c(H+)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
C2H5—OH+HBr![]() C2H5Br+H2O
C2H5Br+H2O
已知反应物的用量为:0.30 mol NaBr(s);0.25 mol C2H5OH(密度为0.80 g·cm-3);36 mL浓H2SO4(质量分数为98%,密度为1.84 g·mL-1);25 mL水。试回答下列问题。
(1)该实验应选择图中的a装置还是b装置?_____________。
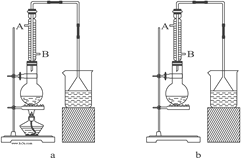
(2)反应装置中的烧瓶应选择下列哪种规格最合适(_____)
A.50 mL B.100 mL C.150 mL D.250 mL
(3)冷凝管中的冷凝水的流向应是(_____)
A. A进B出 B. B进A出 C. 从A进或B进均可
(4)可能发生的副反应为:_____________、__________、______________(至少写出3个方程式)。
(5)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com