
【题目】某无色溶液可能含有K+、Na+、NH4+ 、Ba2+、Fe3+、Fe2+、Cl-、Br-、SO![]() 、SO
、SO![]() 中若干种(忽略水电离出的H+、OH-),且离子浓度相同,依次进行下列实验,且每步所加试剂均过量,观察到现象如下:
中若干种(忽略水电离出的H+、OH-),且离子浓度相同,依次进行下列实验,且每步所加试剂均过量,观察到现象如下:
①用pH试纸检验,溶液的pH大于7。
②向溶液中滴加氯水,再加入CCl4振荡,静置,CCl4层呈橙色。
③向所得水溶液中加入Ba(NO3)2溶液和稀HNO3,有白色沉淀产生过滤,向滤液中加入AgNO3溶液和稀HNO3,有白色沉淀产生。
根据上述实验,以下说法正确的是
A. 无法推断原混合溶液中是否含有NH4+和SO![]()
B. 原混合溶液中Br-、SO![]() 肯定存在,Cl-可能存在
肯定存在,Cl-可能存在
C. 确定溶液中是否存在Na+,需要做焰色反应
D. 原混合溶液中阳离子Ba2+、Fe3+、Fe2+一定不存在,K+、Na+、NH4+一定存在
【答案】D
【解析】由于溶液为无色,因此不可能存在Fe3+、Fe2+;由①可知,溶液呈碱性,说明含有弱酸阴离子,只有亚硫酸根离子能够水解,使溶液显碱性,因此含有SO32-,则不可能含Ba2+;由②中CCl4层呈橙色可知,含Br-离子;由③可知,在②的溶液中加入Ba(NO3)2溶液和稀HNO3,白色沉淀为硫酸钡,由于含SO32-,则可能含有SO42-离子;向滤液中加入AgNO3溶液和稀HNO3,有白色沉淀产生,白色沉淀为AgCl,但由于步骤②加入了氯离子,所以不能确定原溶液是否含氯离子。根据上述分析,溶液中一定没有Ba2+、Fe3+、Fe2+,一定含有Br-、SO32-,因为离子浓度相同,根据溶液显电中性,在则一定含有K+、Na+、NH4+,且不可能存在Cl-和SO42-,否则不满足电荷守恒。A.原混合溶液中含有NH4+,不含SO42-,故A错误;B. 原混合溶液中Br-、SO32-肯定存在,Cl-不可能存在,故B错误;C. Na+一定存在,无需做焰色反应,故C错误;D. 原混合溶液中阳离子Ba2+、Fe3+、Fe2+一定不存在,K+、Na+、NH4+一定存在,故D正确;故选D。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 将少量的 SO2 气体通入 NaClO 溶液中: SO2+H2O+2ClO-=SO32-+2HClO
B. 用 Fe电极电解 NaCl溶液: Fe+2H2O ![]() Fe(OH)2+H2↑
Fe(OH)2+H2↑
C. NaHCO3 溶液与过量澄清石灰水反应: 2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O
D. 用 KMnO4 溶液滴定草酸:2MnO4-+16H++5C2O42-= 2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下为无色液体,而且密度大于水的是( )
①苯 ②硝基苯 ③溴苯 ④四氯化碳 ⑤溴乙烷 ⑥乙酸乙酯
A.①⑥B.②③④⑥C.②③④⑤D.③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如右图,下列判断正确的是( )
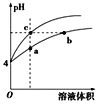
A. a、c两点溶液的导电能力相同
B. b点溶液中c(H+) + c(NH3H2O) = c(OH-)
C. 用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb = Vc
D. a、b、c三点溶液水的电离程度a > b > c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,既能跟盐酸反应,又能跟NaOH溶液反应的化合物是( )
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3 ⑤Fe(OH)3 ⑥Fe2O3
A. ①②③④ B. ②③④ C. ①③④⑤ D. ①②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C9H11Cl的有机物,属于芳香族化合物且苯环上具有两个取代基的化合物共有(不考虑立体异构)
A.9种 B.12种 C.15种 D.18种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境保护与人类生产、生活息息相关。下列做法不利于环境保护的是( )
A.开发利用氢能源B.大力发展公共交通
C.大量使用燃煤D.推广太阳能热水器
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com