
【题目】〔化学——选修4:物质结构与性质〕
Ⅰ.铬位于第四周期ⅥB族,主要化合价+2,+3 ,+6,单质硬度大,耐腐蚀,是重要的合金材料。
(1)基态铬原子的价电子排布图_ ,CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是________(填“极性”或“非极性”)分子。
(2)CrCl3·6H2O实际上是配合物,配位数为6,其固体有三种颜色,其中一种浅绿色固体与足量硝酸银反应时,1mol固体可生成2mol氯化银沉淀,则这种浅绿色固体中阳离子的化学式 。
Ⅱ.砷化镓为第三代半导体材料,晶胞结构如图所示

(3)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的化学方程式为 。
(4)AsH3空间构型为 。已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式是______________________。
(5)砷化镓晶体中最近的砷和镓原子核间距为a cm,砷化镓的摩尔质量为b g·mol-1,阿伏伽德罗常数值为NA,则砷化镓晶体密度表达式是 g·cm-3。
【答案】Ⅰ.(1)![]() 非极性
非极性
(2)[ Cr(H2O)5 Cl ]2+
Ⅱ.(3)(CH3)3Ga+AsH3![]() 3CH4+GaAs
3CH4+GaAs
(4)三角锥形 sp2 (5) 3![]() ·b/16a3NA
·b/16a3NA
【解析】
试题分析:(1)铬是24号元素,其原子核外有24个电子,3d能级上有4个电子、4s能级上有2个电子,3d、4s电子为其价电子,所以其价电子排布图为![]() ,CCl4、CS2都是非极性分子,非极性分子的溶质极易溶于非极性分子形成的溶剂,根据相似相溶原理知,CrO2Cl2是非极性分子。
,CCl4、CS2都是非极性分子,非极性分子的溶质极易溶于非极性分子形成的溶剂,根据相似相溶原理知,CrO2Cl2是非极性分子。
(2)1mol固体可生成2mol氯化银沉淀,说明该配合物的分子的外界有2个氯离子,则该配合物阳离子带两个单位的正电荷,其配位数是6,根据氯原子守恒知,则该配合物內界中含有1个氯原子和5个水分子,所以其阳离子为[ Cr(H2O)5 Cl ]2+ 。
(3)该反应为(CH3)3Ga和AsH3反应生成为GaAs,根据质量守恒可知还有CH4生成,所以反应的化学方程式为:(CH3)3Ga+AsH3![]() 3CH4+GaAs;
3CH4+GaAs;
(4)AsH3中含有3个δ键和1个孤电子对,空间构型为三角锥形,(CH3)3Ga中Ga形成3个δ键,没有孤电子对,为sp2杂化。
(5)AB、AC、AD、BC、BD、CD的边长相等,AF、BF的长相等为a,F位于体心上,O位于正三角形BCD的重心上,在正三角形BCD中,BE为三角形BCD的高,则CE为BC的一半,如图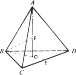 ,设正四面体的边长为x,CE的长为0.5x,BE=
,设正四面体的边长为x,CE的长为0.5x,BE=![]() ;BO与OE的长之比为2:1,则BO的长为
;BO与OE的长之比为2:1,则BO的长为![]() ,在三角形ABO中,AO的长为
,在三角形ABO中,AO的长为![]() ,在三角形BFO中,OF的长为
,在三角形BFO中,OF的长为![]() ,解得
,解得![]() ,正四面体的边长为x,对角线长2x,晶胞的棱长为
,正四面体的边长为x,对角线长2x,晶胞的棱长为![]() ,一个晶胞中含有4个砷化镓,所以密度表达式为
,一个晶胞中含有4个砷化镓,所以密度表达式为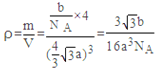 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )
A. 稀有气体元素
B. 左、下方区域的金属元素
C. 右、上方区域的非金属元素
D. 金属元素和非金属元素分界线附近的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,甲溶液的pH=4,乙溶液的pH=5,甲溶液与乙溶液中由水电离的c(H+)之比不可能的是( )
A. 1︰10 B. 10︰1 C. 1︰105 D. 2︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的下列说法中正确的是
A.冰熔化时水分子中共价键发生断裂;
B.原子晶体中共价键越强硬度越大;
C.晶体中分子间作用力越大,分子越稳定;
D.氯化钠溶于水时离子键未被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是( )
A.化合物:氯化钡、纯碱、干冰
B.混合物:碱石灰、水玻璃、液氯
C.氧化物:过氧化钠、臭氧、一氧化碳
D.电解质:盐酸、烧碱、氯化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)据报道,北京奥运会“祥云”火炬燃料为丙烷,悉尼奥运会火炬燃料为丁烷和丙烷混合气。标准状况下,1.0mol丙烷和丁烷的混合气和足量氧气混合完全燃烧后,恢复至原状态,混合气体的体积减小了70.0L,混合气体中丙烷和丁烷的体积比为______
(2)用一个甲基,一个乙基、一个—C3H7分别取代苯环上的氢原子,所得的三取代物有 种。
(3) 组成的混合物中碳的质量分数为 。
组成的混合物中碳的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2 ![]() 2SO3(正反应放热),反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
2SO3(正反应放热),反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是______。(填字母)
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)求该反应达到平衡时SO2的转化率______(用百分数表示)。(写出计算过程)
(3)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质性质与应用对应关系正确的是( )
A. 次氯酸有酸性,可用于漂白、杀菌消毒
B. 纯碱能与酸反应,可用作治疗胃酸过多的药物
C. 液氨汽化时要吸收大量的热,工业上可用作制冷剂
D. 晶体硅的熔点高、硬度大,可用于制作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:步骤一:利用NaClO3在硫酸作用下与SO2反应生成ClO2和一种酸式盐。
步骤二:将ClO2在NaOH溶液中与H2O2反应即可生成NaClO2
回答下列问题:
(1)NaClO2中![]() 的化合价为__________。
的化合价为__________。
(2)写出步骤一中生成ClO2的化学方程式 。
(3)步骤二反应中,氧化剂与还原剂的物质的量之比为__________,该反应中氧化产物是 。
Ⅱ、水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性(KOH)KI溶液,生成MnO(OH)2沉淀,密封静置;一段时间后加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:![]()
(1)写出O2将MnSO4氧化成MnO(OH)2的化学方程式: 。
(2)写出MnO(OH)2与I-完全反应生成Mn2+和I2 的化学方程式 。
Ⅲ、在H2SO4和KI的混合溶液中加入足量的H2O2,放出大量的无色气体,溶液呈棕色,并可以使淀粉变蓝。有学生认为该反应的离子方程式为:H2O2+2KI + H2SO4=I2+ O2↑+H2SO4,这个方程式正确吗?
(填“正确”或“不正确”),理由是 。正确的化学反应方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com