
【题目】A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和实验现象。请回答:

(1)写出C的化学式: ____________,用文字描述实验现象1:______________________。
(2)依次写出B→F和F→H的化学方程式: _________________________________________________________; _________________________________________________________。
(3)A→D主要操作步骤如下图:

甲.加入CCl4后振荡 乙.静置分层 丙.分离
甲、乙、丙3步实验操作中,不正确的是_______(填“甲”、“乙”或“丙”)。
(4)将SO2气体通入D溶液,D溶液变为无色,生成两种酸。写出该反应的化学方程式:_____________________________________。
【答案】 AgI 产生大量棕黄色的烟 2HCl+NaClO+H2O=Cl2+NaCl+H2O Cl2+2NaOH=NaCl+NaClO+H2O 丙 SO2+I2+2H2O=H2SO4+2HI
【解析】钠盐A能和AgNO3溶液反应生成难溶于HNO3的黄色沉淀,可确定A为NaI,C为AgI;F为黄绿色气体,则F是Cl2;F与金属铜反应得到K,则K为CuCl2;F(Cl2)与NaOH反应生成H(含有B的溶液),根据题干中“B呈碱性并具有氧化性”,可推测B为NaClO;将B(NaClO)逐滴加入A(NaI)中得到D(D在CCl4中呈紫色),则D为I2。
(1)由以上分析可知C为AgI;实验现象1为铜在氯气中燃烧产生大量棕黄色的烟;
故答案为:AgI;产生大量棕黄色的烟;
(2)B(NaClO)与浓盐酸反应得到F(Cl2),NaClO具有强氧化性,HCl具有还原性,发生归中反应生成Cl2,故方程式为:2HCl+NaClO+H2O=Cl2+NaCl+H2O;F→H为Cl2与NaOH的反应,反应的方程式为Cl2+2NaOH=NaClO+NaCl+H2O;
故答案为:2HCl+NaClO+H2O=Cl2+NaCl+H2O;Cl2+2NaOH=NaClO+NaCl+H2O;
(3)振荡、静置分层操作合理,而分离时先分离下层液体后倒出上层液体,则丙图不合理;
故答案为:丙;
(4)将SO2气体通入D(I2)溶液,溶液变为无色,生成两种酸。SO2具有强还原性,能被卤素单质氧化为硫酸,I2自身被还原为HI,故反应方程式为:SO2+I2+2H2O=H2SO4+2HI;
故答案为:SO2+I2+2H2O=H2SO4+2HI。


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】根据元素周期律的变化规律,下列比较中,正确的是( )
A. 原子半径:Br>Cl>FB. 氧化性:N2>O2>F2
C. 金属性:Al>Mg>NaD. 非金属性:C>N>P
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中Cl--浓度由大到小的顺序是( )
①200 mL 2 mol/L MgCl2溶液 ②1000 mL 2.5mol/L NaCl溶液 ③300 mL 5 mol/L KCl溶液 ④250 mL 1 mol/LFeCl3溶液
A. ②③①④ B. ④①②③ C. ①④②③ D. ③①④②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 同温同压下,等质量的甲烷比氖气所占有的体积小
B. 3.01×1023个X气体分子的质量为16g,则X气体的摩尔质量是64 g mol-1
C. 0.5L 1 molL-1 FeCl3溶液与0.2L 1 molL-1 KCl溶液中的Cl—的数目之比为15: 2
D. 150ml 1 molL-1NaCl溶液与50ml 1 molL-1AlCl 3溶液中Cl—物质的量浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)在食品加工中常用作防腐剂、漂白剂和疏松剂.焦亚硫酸钠为黄色结晶粉末,150℃时开始分解,在水溶液或含有结晶水时更易被空气氧化.实验室制备焦亚硫酸钠过程中依次包含以下几步反应:
2NaOH+SO2=Na2SO3+H2O …(a)
Na2SO3+H2O+SO2=2NaHSO3…(b)
2NaHSO3 ![]() Na2S2O5+H2O …(c)
Na2S2O5+H2O …(c)
实验装置如下: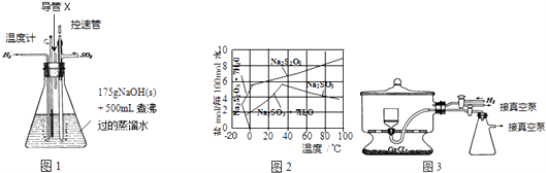
(1)实验室可用废铝丝与NaOH溶液反应制取H2 , 制取H2的离子方程式为 .
(2)图1装置中,导管X的作用是 .
(3)通氢气一段时间后,以恒定速率通入SO2 , 开始的一段时间溶液温度迅速升高,随后温度缓慢变化,溶液开始逐渐变黄.“温度迅速升高”的原因为;
实验后期须保持温度在约80℃,可采用的加热方式为 .
(4)反应后的体系中有少量白色亚硫酸钠析出,参照图2溶解度曲线,除去其中亚硫酸钠固体的方法是;然后获得较纯的无水Na2S2O5应将溶液冷却到30℃左右抽滤,控制“30℃左右”的理由是 .
(5)用图3装置干燥Na2S2O5晶体时,通入H2的目的是;真空干燥的优点是 .
(6)测定产品中焦亚硫酸钠的质量分数常用剩余碘量法.已知:S2O52﹣+2I2+3H2O=2SO42﹣+4I﹣+6H+;2S2O32﹣+I2=S4O62﹣+2I﹣
请补充实验步骤(可提供的试剂有:焦亚硫酸钠样品、标准碘溶液、淀粉溶液、酚酞溶液、标准Na2S2O3溶液及蒸馏水).
①精确称取产品0.2000g放入碘量瓶(带磨口塞的锥形瓶)中.
②准确移取一定体积和已知浓度的标准碘溶液(过量)并记录数据,在暗处放置5min,然后加入5mL冰醋酸及适量的蒸馏水.
③用标准Na2S2O3溶液滴定至接近终点.
④ .
⑤ .
⑥重复步骤①~⑤;根据相关记录数据计算出平均值.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,小明设计了如图所示的实验装置,按要求填空。

①请根据小明的意图,连接相应的装置,接口顺序: 接 , 接 , 接 。(填字母)____________
②U形管中所盛试剂的化学式为_____________;
③装置C中CCl4的作用是__________________;
④小红认为小明的实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,小红同学提出在某两个装置之间再加装置F。你认为装置F应加在____之间(填装置序号)。瓶中可以放入_______;
⑤小强看到小明设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成其他溶液。你认为可将溶液换成________,如果观察到________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含K+、Al3+、NH4+、SO42﹣ . 取500mL该溶液加入过量的氢氧化钡溶液,经过滤、洗涤、干燥,称重得到9.32g固体1,并收集到224mL(标准状况)气体.在滤液中通入过量的CO2 , 经过滤、洗涤、灼烧,称重得到0.51g固体2.原溶液中K+的浓度为( )
A.0.08mol/L
B.0.04mol/L
C.0.02mol/L
D.0.01mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素.请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号) .
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式) .
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系A ![]() B(在水溶液中进行),其中C是溶于水显酸性的气体;D是淡黄色固体.写出C的结构式;D的电子式 . 如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为 , 由A转化为B的离子方程式为 .
B(在水溶液中进行),其中C是溶于水显酸性的气体;D是淡黄色固体.写出C的结构式;D的电子式 . 如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为 , 由A转化为B的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分离或除杂方法不正确的是( )
A.用分液法分离水和酒精
B.用蒸馏法分离苯和溴苯
C.用结晶法除去硝酸钾中的氯化钠杂质
D.用饱和NaHCO3溶液除去CO2中混有的少量HCl气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com