
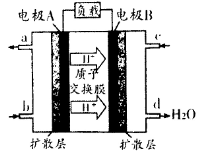
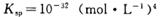 ,当Cr3+浓度小于10
,当Cr3+浓度小于10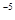 mol
mol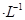 时可认为完全沉淀,电解完全后,测得溶液的pH=6,则该溶液过滤后为___________(填“能”或“否”)直接排放。
时可认为完全沉淀,电解完全后,测得溶液的pH=6,则该溶液过滤后为___________(填“能”或“否”)直接排放。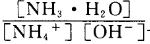 ________(填“增大”“减小”或“不变”);25
________(填“增大”“减小”或“不变”);25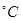 时,NH3?H2O的电离平衡常数
时,NH3?H2O的电离平衡常数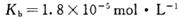 ,该温度下,1mol
,该温度下,1mol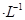 的NH4Cl溶液中
的NH4Cl溶液中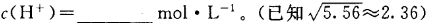
 为NH4+水解平衡常数的倒数,NH4Cl溶液中加入少量NaOH,平衡常数不变,则该比值不变;根据盐类的水解与弱电解质电离的关系,水解平衡常数Kh=Kw/Kb=1.0×10-14mol2/L2÷(1.8×10-5mol?L?1)=5.56×10-10mol?L?1,则c(NH3?H2O)?c(H+)/c(NH4+)=5.56×10-10mol?L?1,因为c(NH3?H2O)≈c(H+),c(NH4+)≈1mol?L?1,带入计算式可得c(H+)=2.36×10-5mol?L?1。
为NH4+水解平衡常数的倒数,NH4Cl溶液中加入少量NaOH,平衡常数不变,则该比值不变;根据盐类的水解与弱电解质电离的关系,水解平衡常数Kh=Kw/Kb=1.0×10-14mol2/L2÷(1.8×10-5mol?L?1)=5.56×10-10mol?L?1,则c(NH3?H2O)?c(H+)/c(NH4+)=5.56×10-10mol?L?1,因为c(NH3?H2O)≈c(H+),c(NH4+)≈1mol?L?1,带入计算式可得c(H+)=2.36×10-5mol?L?1。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.CO32-+H2O?HCO3-+OH-用热的纯碱溶液清洗油污 |
| B.Al3++3H2O?Al(OH)3(胶体)+3H+:明矾净水 |
| C.Al3++3HCO3-?Al(OH)3↓+3CO2↑:泡沫灭火器灭火 |
| D.SnCl2+H2O?Sn(OH)Cl↓+HCl配制氯化亚锡溶液时加入氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.已知Cu2O+2H+=Cu2++Cu+H2O,氢气还原氧化铜后生成的红色固体能完全溶于稀硝酸,说明还原产物是铜 |
| B.在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的冷却温度作为末温度 |
| C.仅用淀粉溶液、稀硫酸、碘水、新制氢氧化铜四种试剂可完成淀粉水解产物及水解程度检验的探究实验 |
| D.向盛有少量Mg(OH )2悬浊液的试管中滴加氯化铵溶液,可以看到沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验目的 |
| A | 向5 mL 0.1 mol/L AgNO3溶液中滴加3滴0.1 mol/LNaCl溶液,产生白色沉淀;再向其中滴加3滴0.1mol/L的KI溶液,有黄色沉淀产生 | 验证Ksp(AgCl)> Ksp(AgI) |
| B | 向适量样品溶液中滴加KSCN溶液 | 检验FeSO4溶液是否被氧化 |
| C | 向适量样品溶液中滴加盐酸酸化,再滴加BaCl2溶液 | 检验Na2SO3溶液是否被氧化 |
| D | 向Na2SiO3溶液中通入CO2 | 验证非金属性:碳>硅 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cl-、Br-、CrO42- | B.CrO42-、Br、Cl- | C.Br-、Cl-、CrO42- | D.Br、CrO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | CH3COOAg | AgCl | Ag2CrO4 | Ag2S |
| Ksp | 2.3×10-3 | 1.77×10-10 | 1.12×10-12 | 6.7×10-15 |
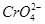 和Cl-的溶液中慢慢滴入AgNO3溶液时,
和Cl-的溶液中慢慢滴入AgNO3溶液时,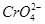 先沉淀
先沉淀查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
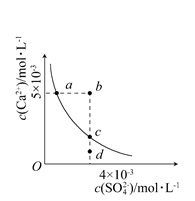
| A.在任何溶液中,c(Ca2+)、c(SO42—)均相等 |
| B.b点将有沉淀生成,平衡后溶液中c(SO42—)一定等于3×10-3mol·L-1 |
| C.a点对应的Ksp等于c点对应的Ksp |
| D.d点溶液通过蒸发可以变到c点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com