
为了证明一水合氨(NH3·H2O)是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验:0.01 mol·L-1氨水、0.1 mol·L-1NH4Cl溶液、NH4Cl晶体、酚酞试剂、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.01 mol·L-1氨水的pH为10,则认定一水合氨是弱电解质,你认为这一方法是否正确?(填“是”或“否”)________,并说明理由:_________________________
________________________________________________________________________。
(2)乙取出10 mL 0.01 mol·L-1氨水,用pH试纸测出其pH=a,然后用蒸馏水将其稀释至1 000 mL,再用pH试纸测出其pH为b,若要确认一水合氨是弱电解质,则a、b值应满足什么条件?________________________________________________________________________
(用等式或不等式表示)。
(3)丙取出10 mL 0.0 1 mol·L-1氨水,滴入2滴酚酞溶液,显粉红色,再加入NH4Cl晶体少量,颜色变____________(填“深”或“浅”)。
1 mol·L-1氨水,滴入2滴酚酞溶液,显粉红色,再加入NH4Cl晶体少量,颜色变____________(填“深”或“浅”)。
(4)请你根据所提供的试剂,再提出一个既合理又简便的方案证明一水合氨是弱电解质:________________________________________________________________________。
解析 (1)NH3·H2O NH
NH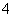 +OH-,0.01 mol·L-1氨水中,c(OH-)=10-4 mol·L-1,证明NH3·H2O部分电离,是弱电解质。
+OH-,0.01 mol·L-1氨水中,c(OH-)=10-4 mol·L-1,证明NH3·H2O部分电离,是弱电解质。
(2)若NH3·H2O是强电解质,稀释过程中OH-总数可看成不变,稀释后c(OH-)=10-(a-2) mol·L-1;若NH3·H2O是弱电解质,稀释过程中电离平衡向生成OH-方向移动,溶液中OH-的总数增加,所以稀释100倍后c(OH-)>10-(a-2) mol·L-1,即b>a-2。
(3)0.01 mol·L-1氨水(滴有酚酞)中加入氯化铵晶体后颜色变浅,有两种可能:一是氯化铵在水溶液中显酸性,加入氨水中使溶液的pH降低;二是NH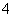 使NH3·H2O的电离平衡逆向移动,从而使溶液的pH降低。所以用这种方法可证明一水合氨是弱电解质。
使NH3·H2O的电离平衡逆向移动,从而使溶液的pH降低。所以用这种方法可证明一水合氨是弱电解质。
(4)从题干中给出的试剂看,还可以选用pH试纸、0.1 mol·L-1NH4Cl溶液进行实验来验证NH3·H2O是弱电解质。因为由“NH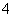 水解显酸性”可判断“NH3·H2O是弱碱”。
水解显酸性”可判断“NH3·H2O是弱碱”。
答案 (1)是 0.01 mol·L-1氨水的pH=10,说明c(OH-)=10-4 mol·L-1,即NH3·H2O没有完全电离 (2)a-2<b<a (3)浅 (4)取一张pH试纸,再用玻璃棒蘸取0.1 mol·L-1NH4Cl溶液,点在pH试纸上,显色后跟标准比色卡比较测其pH,若pH<7,则证明NH3·H2O是弱电解质


科目:高中化学 来源: 题型:
N和B元素在化学中有很重要的地位。
(1)写出与N元素同主族的As元素的基态原子核外电子排布式_________________。
从原子结构的角度分析B、N和O元素的第一电离能由大到小的顺序为___________。
(2)N元素与B元素的氟化物化学式相似,均为AB3型,但分子的空间结构有很大不同,其中NF3的分子空间构型为 ,BF3的分子空间构型为 。
(3)NaN3是抗禽流感药物“达菲”合成过程中的中间活性物质,NaN 3也可用于汽
车的保护气囊。3 mol NaN 3受撞击会生成4 mol N2气体和一种离子化合物A。
①请写出上述NaN 3撞击反应的化学方程式 。
②根据电子云的重叠方式判断:N2分子与NH3分子中σ键数目之比为 : 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,对于反应N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是
2NH3(g) ΔH=-92.4 kJ·mol-1。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是

A.将1 mol氮气、3 mol氢气,置于1 L密闭容器中发生反应,放出的热量 为92.4 kJ
为92.4 kJ
B.平衡状态由A变到B时,平衡常数K(A)<K(B)
C.上述反应在达到平衡后,增 大压强,H2的转化率增大
大压强,H2的转化率增大
D.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.1 mol·L-1CH3COOH溶液加水稀释或加入少量CH3COONa晶体时都会引起
A.CH3COOH电离程度变大
B.溶液pH减小
C.溶液的导电能力减弱
D.溶液中c(H+)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定体积的NaOH溶液分成两等份,一份用pH=2的一元酸HA溶液中和,消耗酸溶液的体积为V1;另一份用pH=2的一元酸HB溶液中和,消耗酸溶液的体积为V2;则下列叙述正确的是
A.若V1>V2,则说明HA的酸性比HB的酸性强
B.若V1>V2,则说明HA的酸性比HB的酸性弱
C.因为两种酸溶液的pH相等,故V1一定等于V2
D.HA、HB分别和NaOH中和后,所得的溶液都一定呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作或对实验事故的叙述正确的是( )
A.用稀硝酸清洗做过银镜反应实验的试管
B.配制浓硫酸和浓硝酸的混合酸时,将浓硝酸沿器壁慢慢加入到浓硫酸中,并不断搅拌
C.不慎将液溴沾到皮肤上,立即用NaOH溶液清洗
D.用瓷坩埚高温熔融NaOH和Na2CO3固体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质接触空气后,可能因发生氧化还原反应而变质的是( )
① NaOH ② A1(OH)3 ③ Fe (OH)3 ④ Fe (OH)2 ⑤ Mg(OH)2
A.① B.④ C.①③④ D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
我国青海查尔汗盐湖蕴藏着丰富的食盐资源。经分析知道,该湖水中含有高浓度的Na+、K+、Mg2+及Cl-等。利用盐湖水可得到某些物质。其主要工业流程如下:
请根据上述流程,回答下列问题:
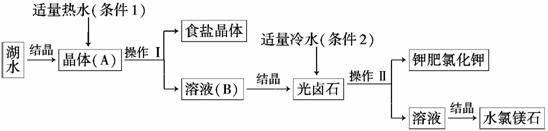
请根据上述流程,回答下列问题:
(1)利用湖水得到晶体(A)的方法是________结晶法(填“降温”或“蒸发”)。
(2)操作Ⅰ的名称为________,此操作适用于分离______________。
(3)本流程中分别采用条件1和条件2获得不同晶体,所 依据的物理量是________。
依据的物理量是________。
a.摩尔质量 b.溶解度 c.溶解性 d.熔沸点
(4)检验钾肥中是否含有Na+的实验方法是________________,若含有Na+,能观察到的现象是________________。
若需得到高纯度的钾肥,可以采用的提纯方法为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com